基因工程学习笔记
绪论
Basic steps in gene cloning
- 将DNA片段插入载体;
- 导入宿主细胞
- recombinant molecule 复制
- 宿主细胞分裂
- plating产生clony
basic steps in PCR:特异引物识别DNA片段从而使其被复制从而富集
- 94°C 氢键断开, 双链分开
- 50-60°C, DNA与引物杂交, 退火
- 74°C, Taq DNA polymerase(抗高温), 引物5’->3’复制
- 94°C下一轮循环
- Limitation of PCR:
- 必须知道退火位点,也即知道引物结合地方序列;
- 长度限制: 5kb-40kb(特殊技术可以最高复制40kb)
- usage:
- virus dectation: 高倍扩增
- purifying gene
载体
Plasmid
- 载体要求:
- 能够在宿主体内复制: 含有复制起点
- 理想大小小于10kb,大了会断开,而且不易于操作;
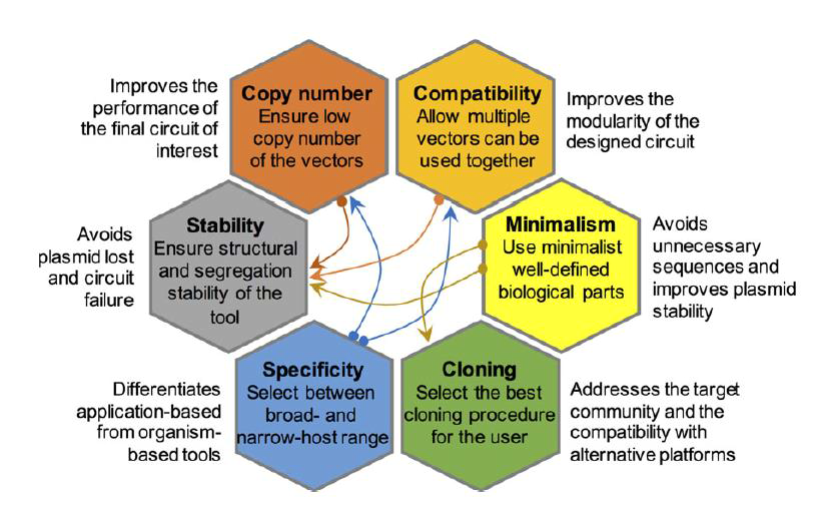
- 宿主细胞:大肠杆菌, 一次只接受一个质粒拷贝;
- 类型I: plasmids,
- 环形分子
- 独立于基因组
- 携带一个或多个基因
- 携带抗体基因可作为选择性标签,四环素和青霉素抗性基因;
- 质粒复制方式:
- integrative:插入宿主基因组复制
- non-integrative:含有复制起始位点,独立复制,也称为episome;
- copy number: 宿主体内独立存在的质粒分子数;
- stringent:少但是大, 1-2/cell
- relaxed:多, over 50/cell
- conjugation:
- 物理接触
- 产生pilus(管道?)
- 宿主DNA滚环复制并转移到受体中
- conjugative&non-conjugative:产生pilus or not;
- 由于conjugative plasmid 会传播至其他细胞;
- tra基因控制(含有则conjugative)
- compatibility:是否两质粒能共存;
- incompatiblity:在复制过程中两个子代细胞分别获得一个
- F plasmid/F factor: 含有tra基因,conjugative;
Bacteriophage(Phage)
- 噬菌体特征:
- 侵染细菌
- 结构简单
- 含有DNA|RNA:编码复制的基因
- Capsid:外衣
- 类型I:λ phage
- episome
- 环状和线性DNA之间切换(cos位点)
- 基因成簇排列
- 裂解型
- 感染时间小于20min
- 基因组大小49kb
- prophage:整合进基因组的噬菌体DNA;
- lysogen:携带prophage的宿主;
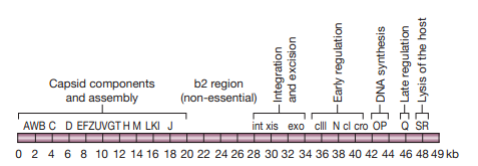
- 编码capsid的基因成簇排列
- 便于控制基因组表达
- b2 region: 可以删掉以增加能放进capsid的外源DNA长度
- cos site:sticky end
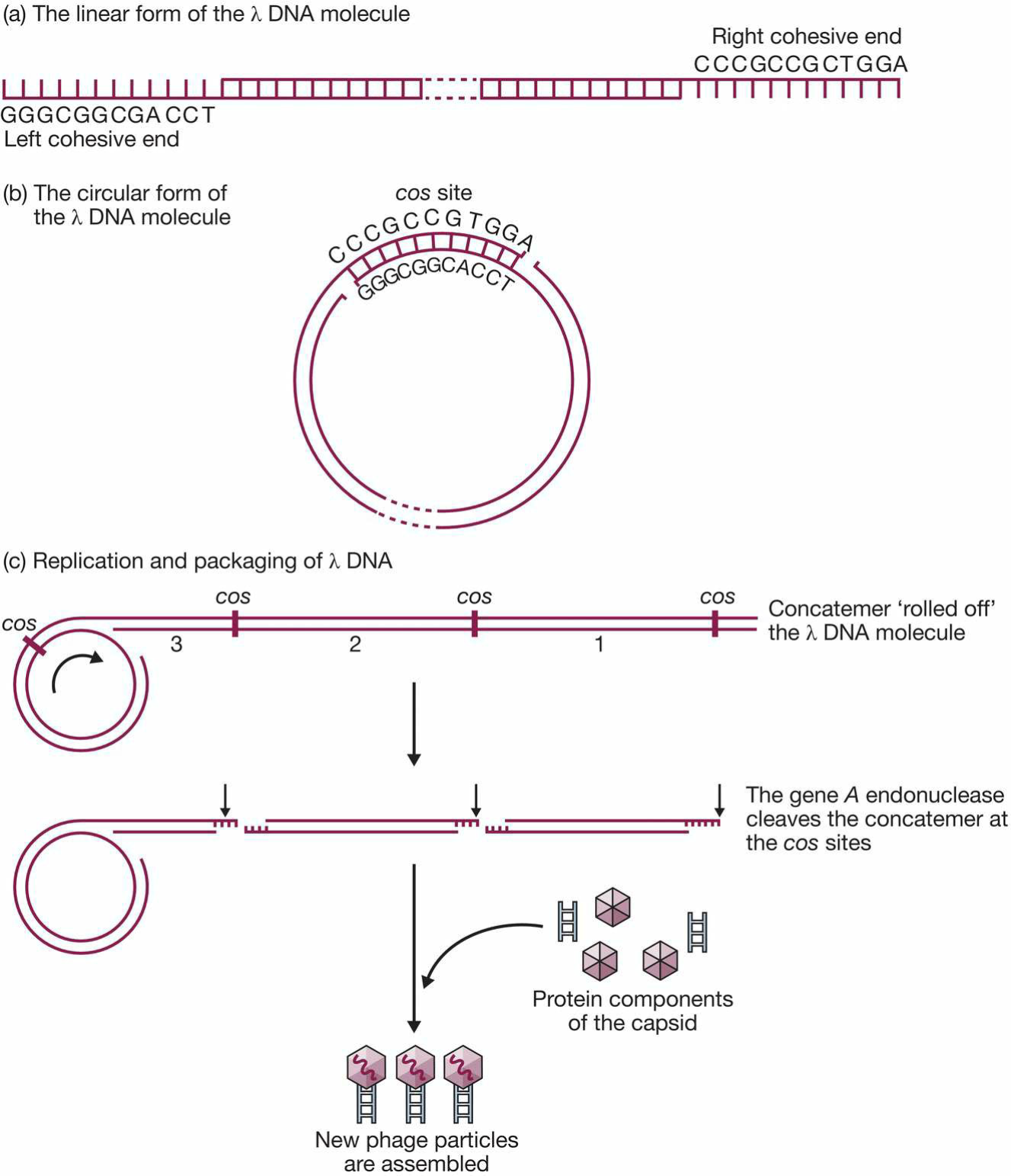
- 线性的DNA分子通过两cos位点环化,从宿主基因组脱离
- 内切酶识别序列,能够将滚环复制得到的长链切断成单个噬菌体基因组
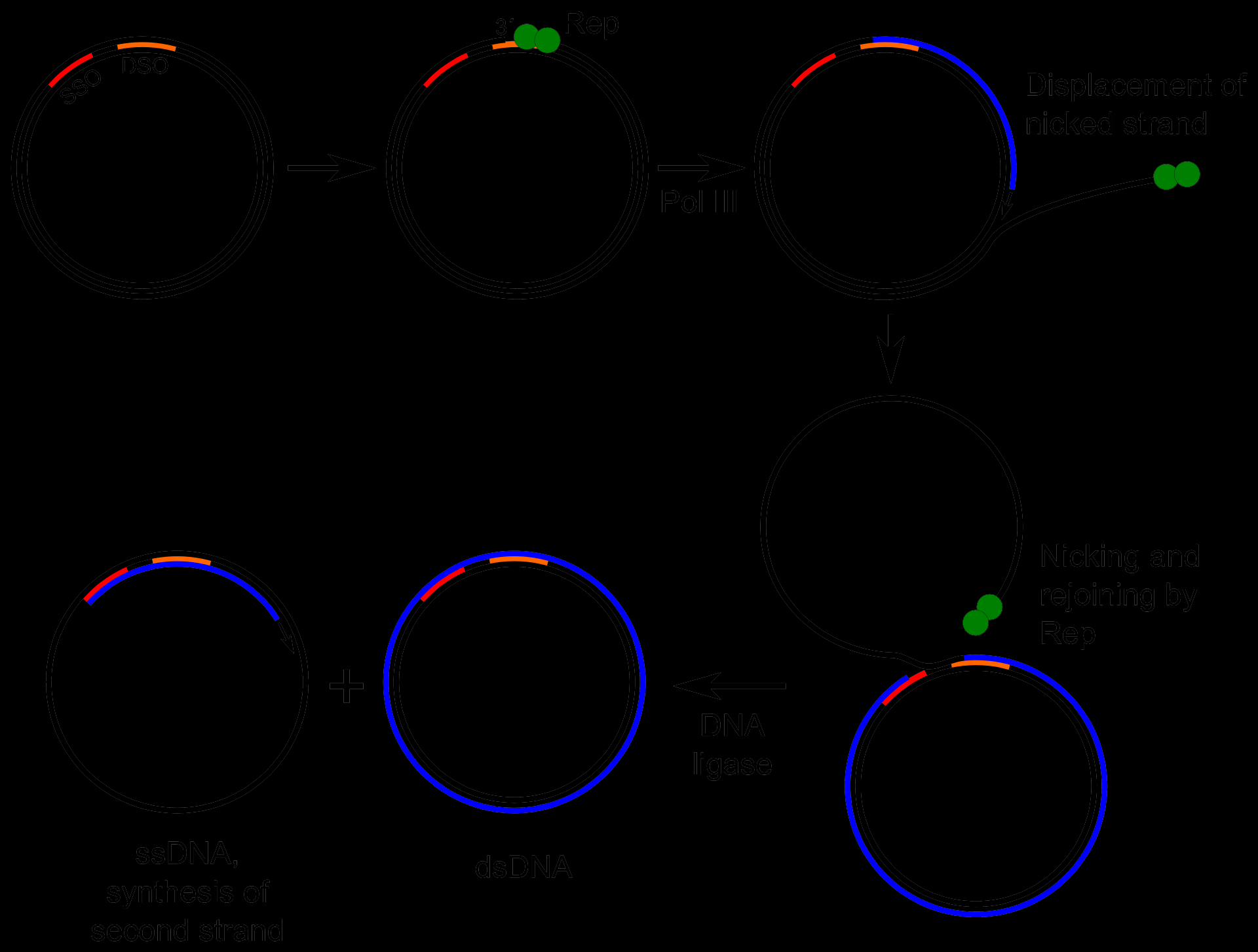
- 类型II:M13
- 环状, 但是却是单链DNA
- 不发生细胞裂解,M13颗粒持续释放
- capsid由三个基因的多份拷贝(不是多次复制)编码
- 不发生整合
- M13复制流程:
- 单链DNA注入并合成双链,称为RF,复制态
- 双链DNA 通过滚环复制生成新的RF
- 双链replicative form(RF)通过滚环机制重新产生单链DNA(滚环但是不复制)
- 单链DNA环化并组装
- M13的优势:
- 基因组小于10kb;
- RF类似质粒,能够以质粒形式感染;
- 单链形式DNA有利于测序和体外突变(in vitro mutagenesis);还能用于phage display(将要表达的蛋白基因和衣壳基因连在一起使其位于噬菌体外部)
DNA纯化
- Terminology:
- Total cell DNA: genomic DNA加上additional DNA molecules(如质粒)
- Pure plasmid DNA:从细菌中提取,去除genomic DNA后的;
- Phage DNA:from bacteriophage particles
- 需要去除衣壳(M13除外,RF直接na)
- Defined medium: all the components are known(M9)
- Undefined medium:the precise identity and quantity of the components are not known(LB)
- Basic steps:
- 细菌培养
- E.coli培养:
- LB medium
- 37°C
- 摇床充气
- 检测细胞浓度:
- 光学法:测量在600nm处的吸光度(光密度OD是在特定波长下的吸光度)
- $1\ OD_{600} = 0.8\times 10^9\ cells/ml$
- E.coli培养:
- 离心使细胞裂解
- 细胞抽提(去除除DNA外组分)
- 物理方法:研磨
- 化学方法:
- 溶菌酶:digests the cell wall
- EDTA: removes magnesium ions
- sodium dodecyl sulphate (SDS):removes lipid molecules.
- 离心:remove insoluble debris
- DNA纯化:
- 方法1:降解污染物
- proteinase K处理: 消化蛋白质;
- 苯酚和氯仿混合(Phenol&chloroform):沉淀蛋白质
- ribonuclease:去除RNA
- 方法2:组分分离
- 离子交换层析:DNA, RNA,部分蛋白质带负电结合与正电树脂,随后盐溶液洗脱,RNA+protein首先脱出,DNA最后,保留;
- silica method:
- guanidinium thiocyanate硫氰酸胍:将除DNA外的物质变性, 同时使得DNA结合于silica particles;
- 方法1:降解污染物
- DNA富集:
- Ethanol precipitation:$Na^+$, -20°C条件
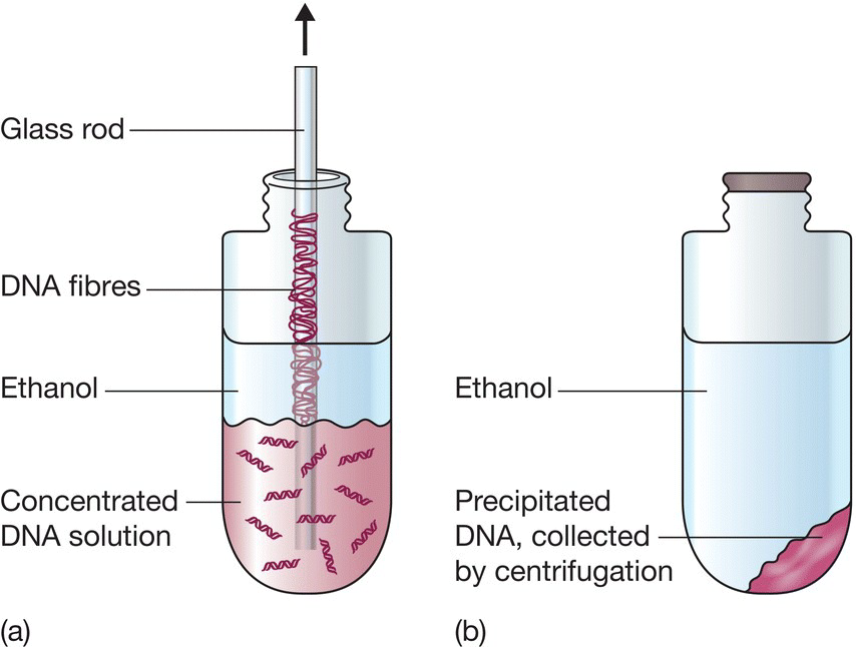
- 玻璃棒搅动附着DNA
- 离心沉淀DNA
- DNA浓度: 测量在260nm波长时的吸光度
- $1 \ OD_{260} = 50\ ug/ml$
- DNA纯度:
- The ratio of the absorbances at 260 and 280 nm
- around 1.8 with a pure DNA sample.
- 细菌培养
- 分离质粒和细菌基因组:
- 物理性质:
- 质粒DNA分子较小, 细菌基因组较大
- 质粒和细菌基因组都为环状,但是在细胞抽提时基因组会断裂成线性分子,所以我们要做的是分离环状DNA分子;
- 质粒DNA双链的两种形式:
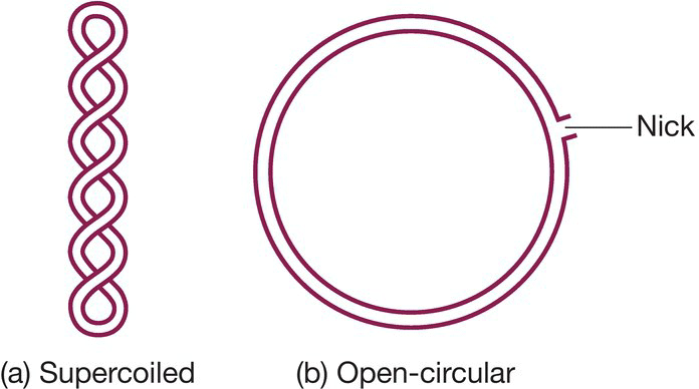
- Covalently closed circular (ccc) DNA (Supercoiled DNA)
- Open-circular (oc) DNA
- 超螺旋分子能很轻易地从非超螺旋分子中分离,且大多数质粒以超螺旋形式存在于细胞中;
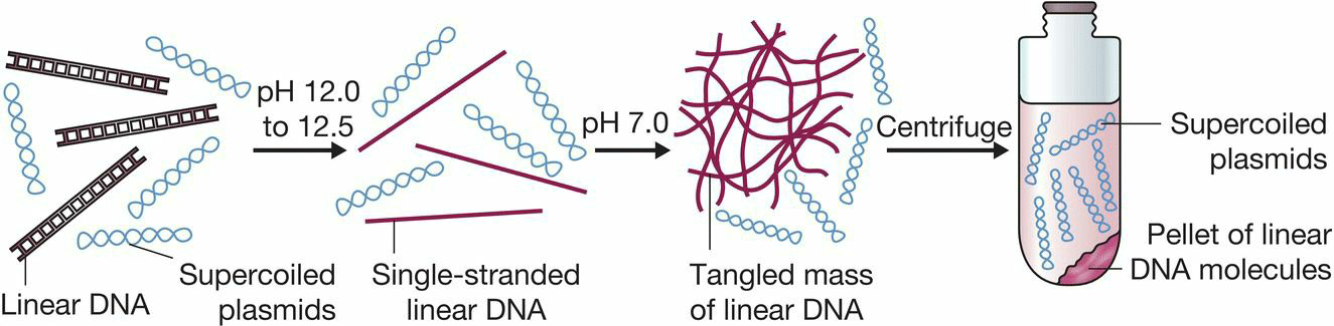
- alkaline denaturation:碱变性法
- 线性DNA在高PH时变性双链分开,而超螺旋质粒则保持原样;
- 再将PH调回7,DNA分子复性,但交织在一起,通过离心被去除;
- 这一过程大部分RNA和蛋白质也变得不溶, 被离心去除;
- 氯化铯密度梯度离心:
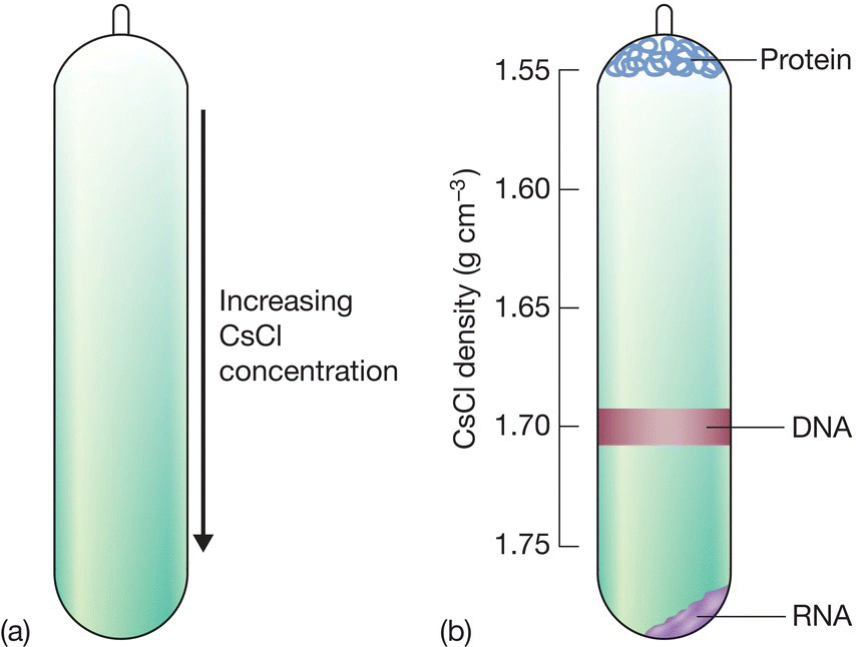
- 密度不同,导致蛋白质(浮力小)在管的顶部,而RNA则相反在底部,DNA的浮力密度在蛋白质与RNA之间故而在管中间;
- EtBr处理:分离超螺旋DNA和其他DNA
- EtBr通过插入相邻碱基对与DNA结合,导致双螺旋部分解开。
- 超螺旋不易结合故而浮力密度减少较少,而线性分子减少较多;
- 物理性质:
质粒扩增:
- 多拷贝质粒能够在没有蛋白质合成的情况下复制
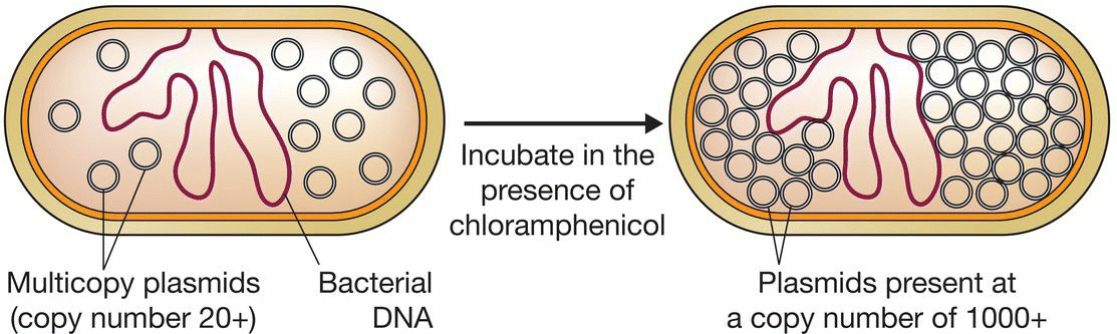
- 氯霉素, 蛋白质合成抑制;
λ噬菌体DNA获取:
- 获取噬菌体颗粒: 侵染后离心后噬菌体颗粒在清液层,而细菌沉积;
- 噬菌体分为烈性噬菌体和溶原性噬菌体;
- 在感染于寄主细菌细胞时,前者往往在菌体内增殖并将菌体裂解;
- 后者则不使细菌裂解,而成为与细胞同步增殖的遗传因子——原噬菌体。
- 温和噬菌体的基因组整合于宿主菌基因中,这种整合在细菌染色体上的噬菌体基因称为原噬菌体,原噬菌体可随细菌染色体的复制而复制,并通过细菌的分裂传给下一代,不引起细菌裂解,这种带有原噬菌体的细菌称为溶原性细菌。
- lysogenic型λ噬菌体获取:
- cI基因:控制噬菌体处于prophage状态;
- 在cI内引入一个温度敏感突变(temperature-sensitive,即cIts)
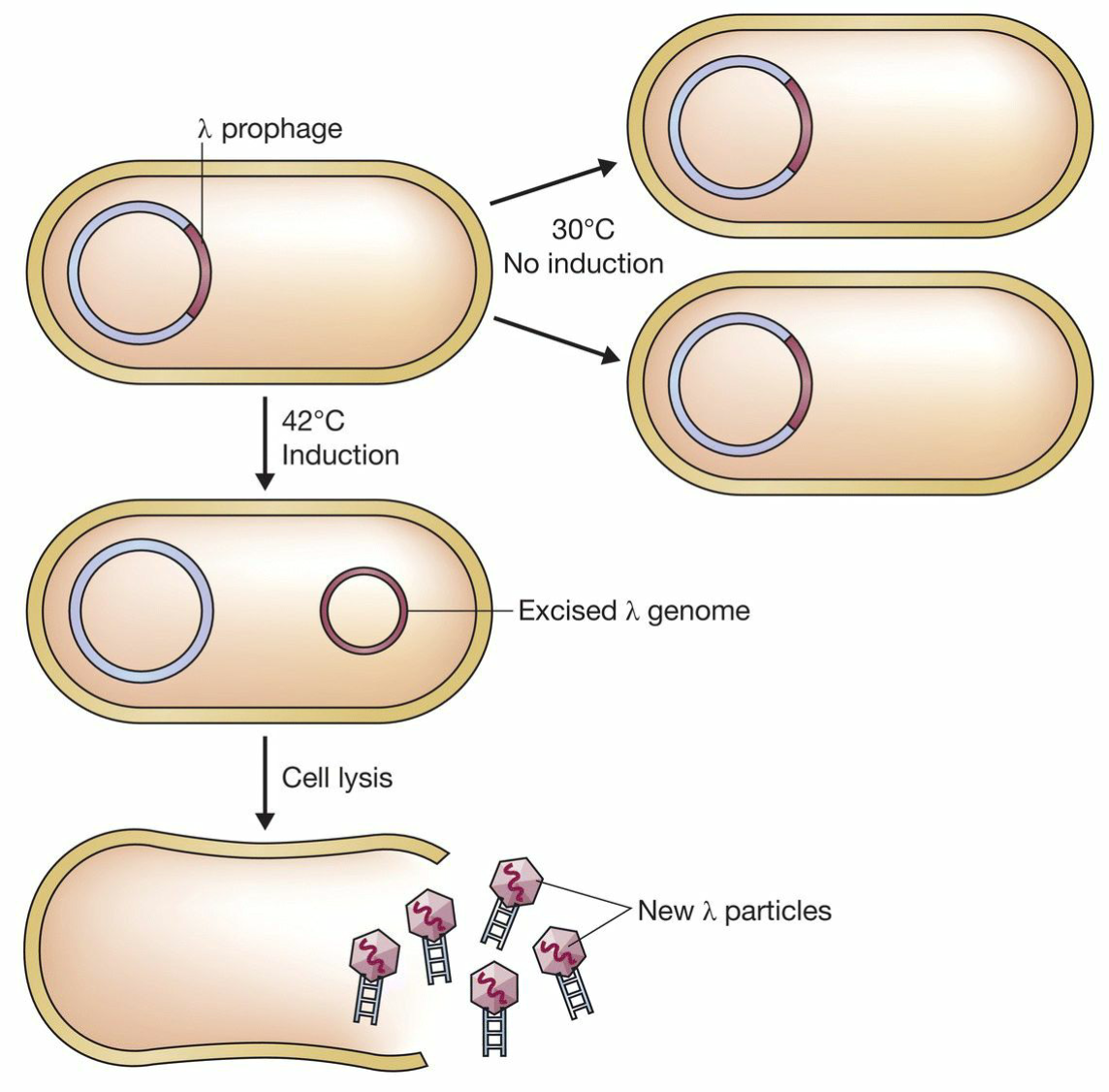
- 30°C:正常分裂;
- 42°C:裂解;
- cI基因:控制噬菌体处于prophage状态;
- non-lysogenic型λ噬菌体获取:
- 许多载体都删除了cI基因,无法整合入细菌基因组;
- 所以只能通过细胞裂解获得噬菌体,故而需要注意噬菌体与细菌的比例;
- 噬菌体分为烈性噬菌体和溶原性噬菌体;
- 富集噬菌体颗粒:
- PEG,一种长链多聚化合物,在有盐的条件下能够让噬菌体颗粒沉淀;
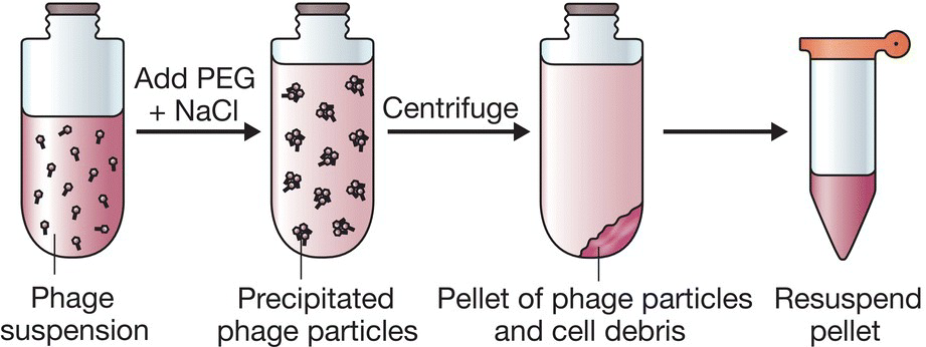
- 能够有效减少悬液的体积,有助于DNA提取;
- 噬菌体颗粒提纯:氯化铯密度梯度离心;
- 去除细菌残骸,DNA;
- DNA提取:只要去除蛋白外壳即可,苯酚或者蛋白酶处理;
- 获取噬菌体颗粒: 侵染后离心后噬菌体颗粒在清液层,而细菌沉积;
- M13噬菌体DNA获取:
- Replicative form形式同质粒一样获取;
- 单链DNA形式获取:
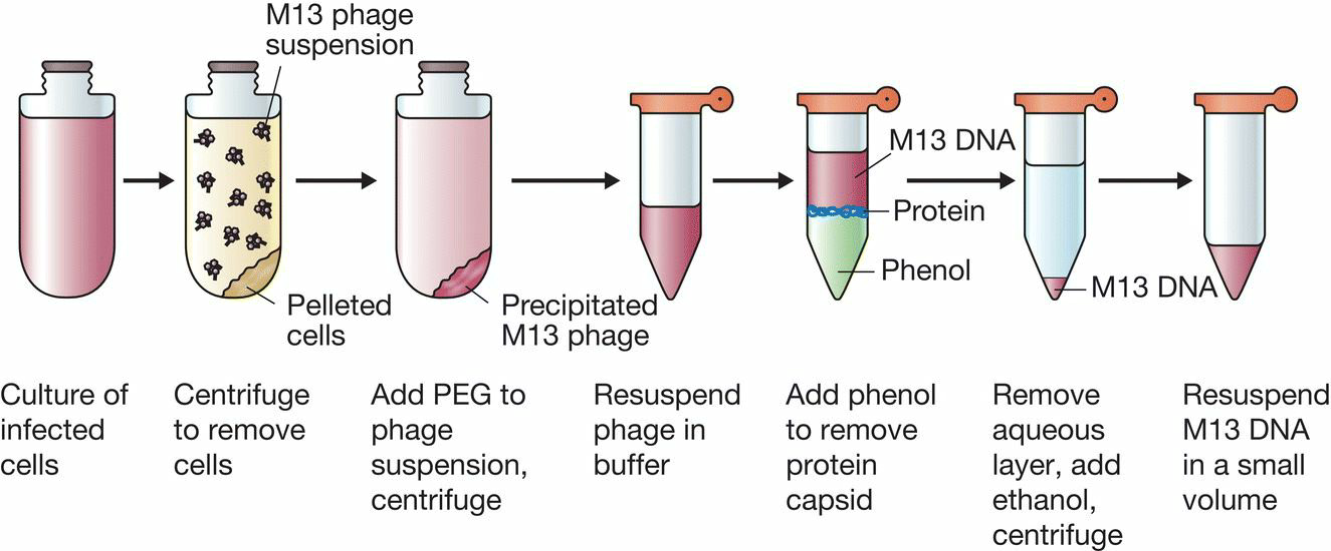
- 类似λ烈性菌;
Manipulation of Purified DNA
- DNA外切酶:
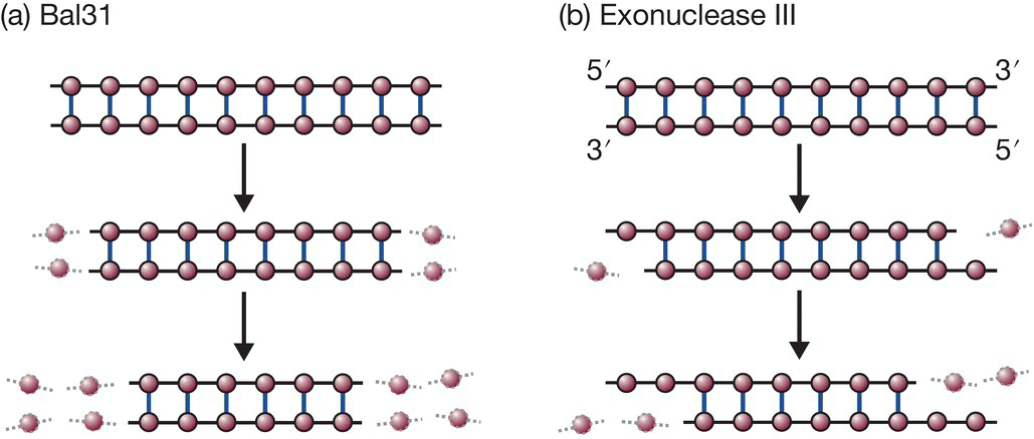
- 直接移除双链末端碱基对;
- 移除双链中一条单链的末端核苷酸;
- DNA内切酶:
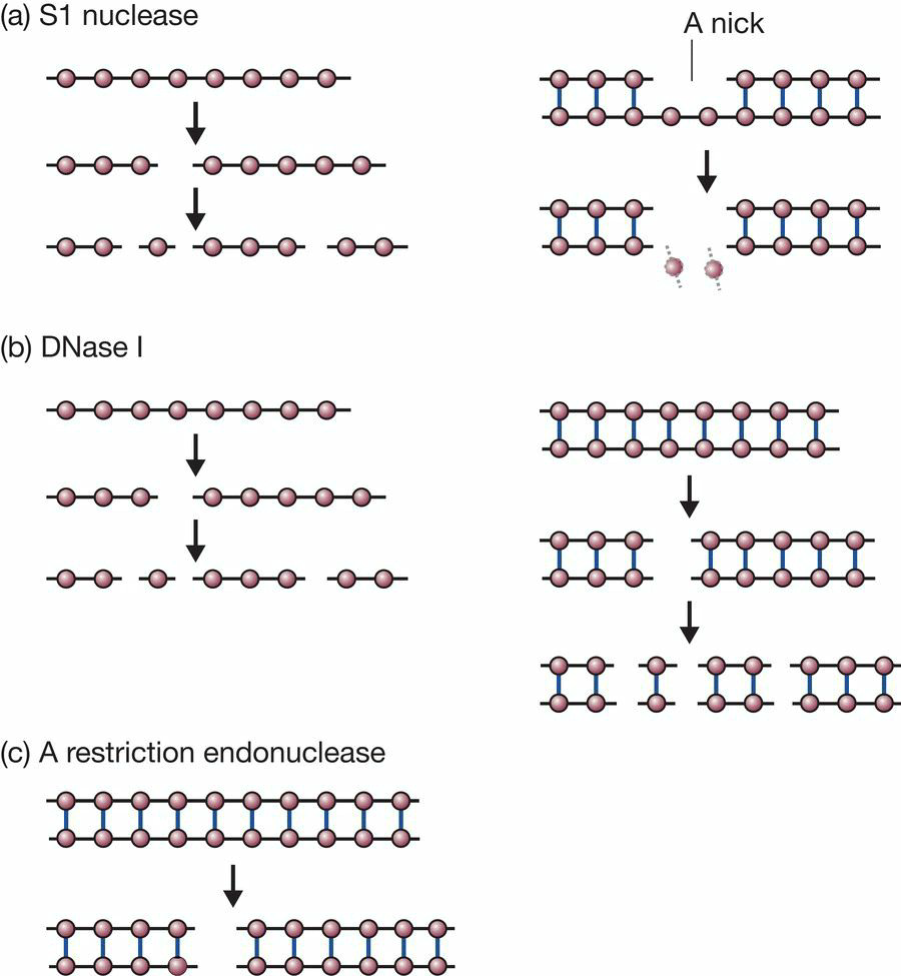
- 只能切开单链,或者双链中裸露的单链;
- 既可以切单链也可以切双链;
- 在特异性位点切割双链;
DNA连接酶:
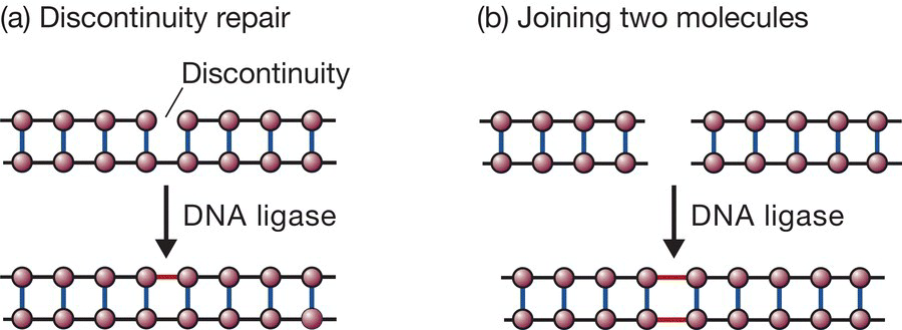
- 连接双链中的单链断开
- 连接两双链分子
DNA聚合酶:
- 需要有双链区(primer)起始聚合;
- DNA聚合酶I
- 5’-3’外切酶活性由一个323氨基酸片段决定,失去这一片段不影响聚合酶功能,但是无法解聚DNA, 缺失该片段后的酶,叫做Klenow fragment;(注意是这个修改后的酶!!!)
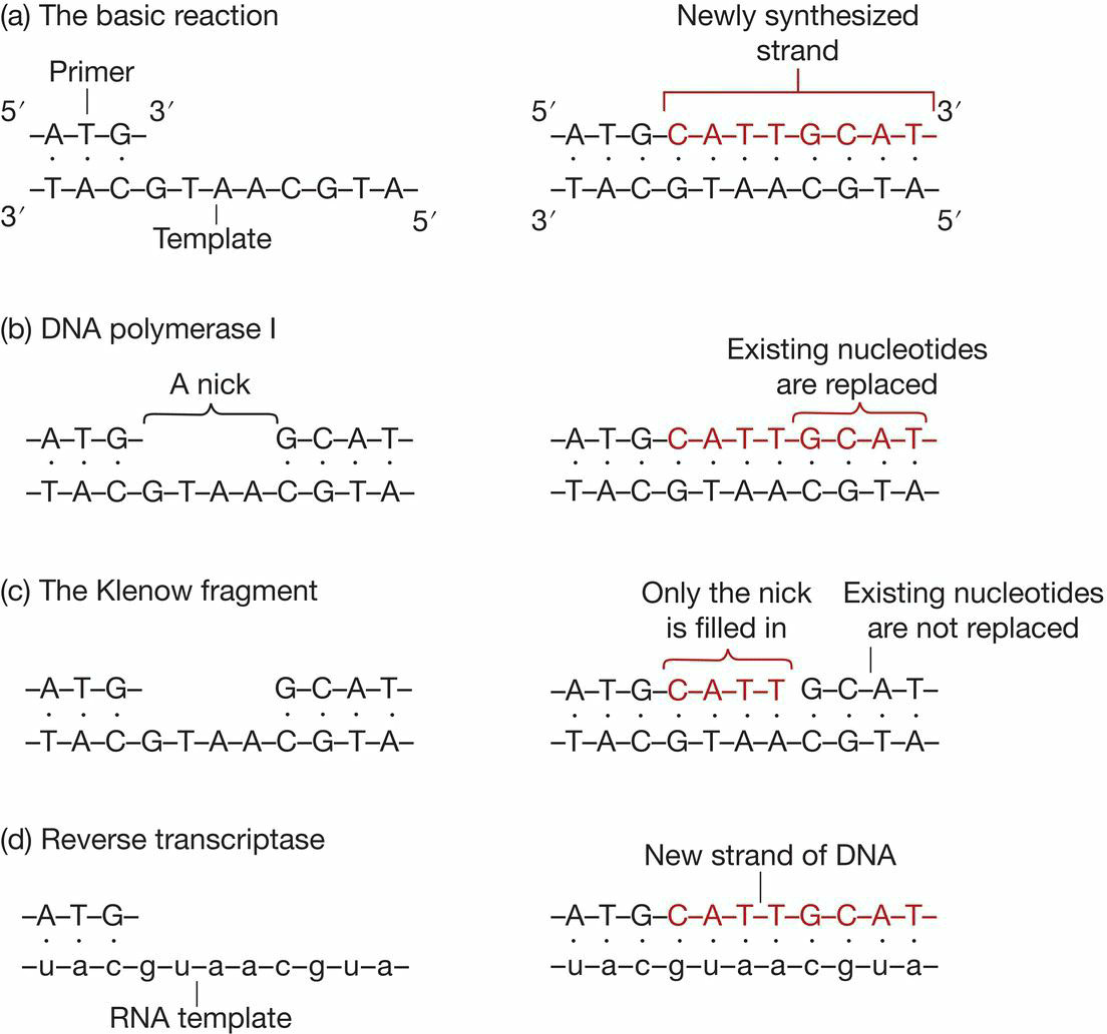
- 修复功能通过替换旧链方式实现,当5’-3’外切酶功能失去后,只能填充缺口,无法切除确实部分;
- 注意5’-3’外切酶,缺口处理方向;
- Taq DNA polymerase:
- 耐高温的嗜热菌DNA聚合酶I
- DNA modifying enzymes
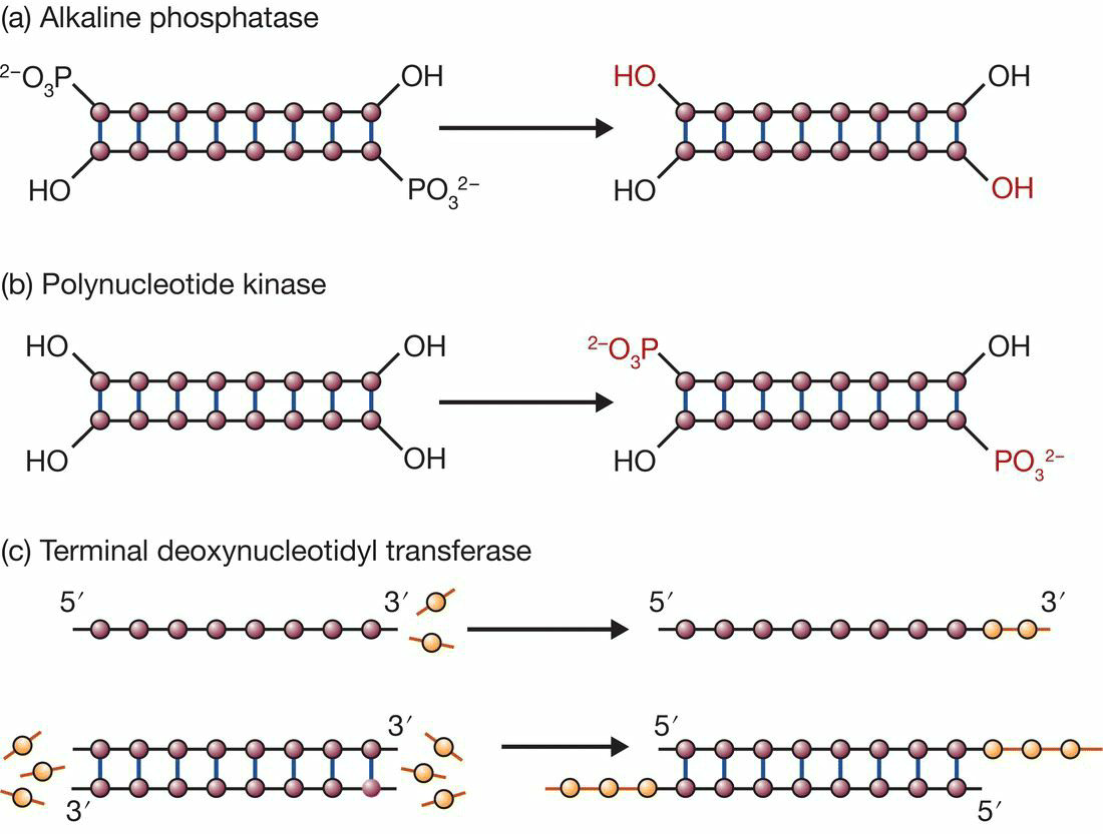
- 去除5‘端末端磷酸基团
- 重新在5’端接上磷酸基团
- 将脱氧核苷酸加到DNA链(单双)3‘末端(OH基团)
- 限制性内切酶:
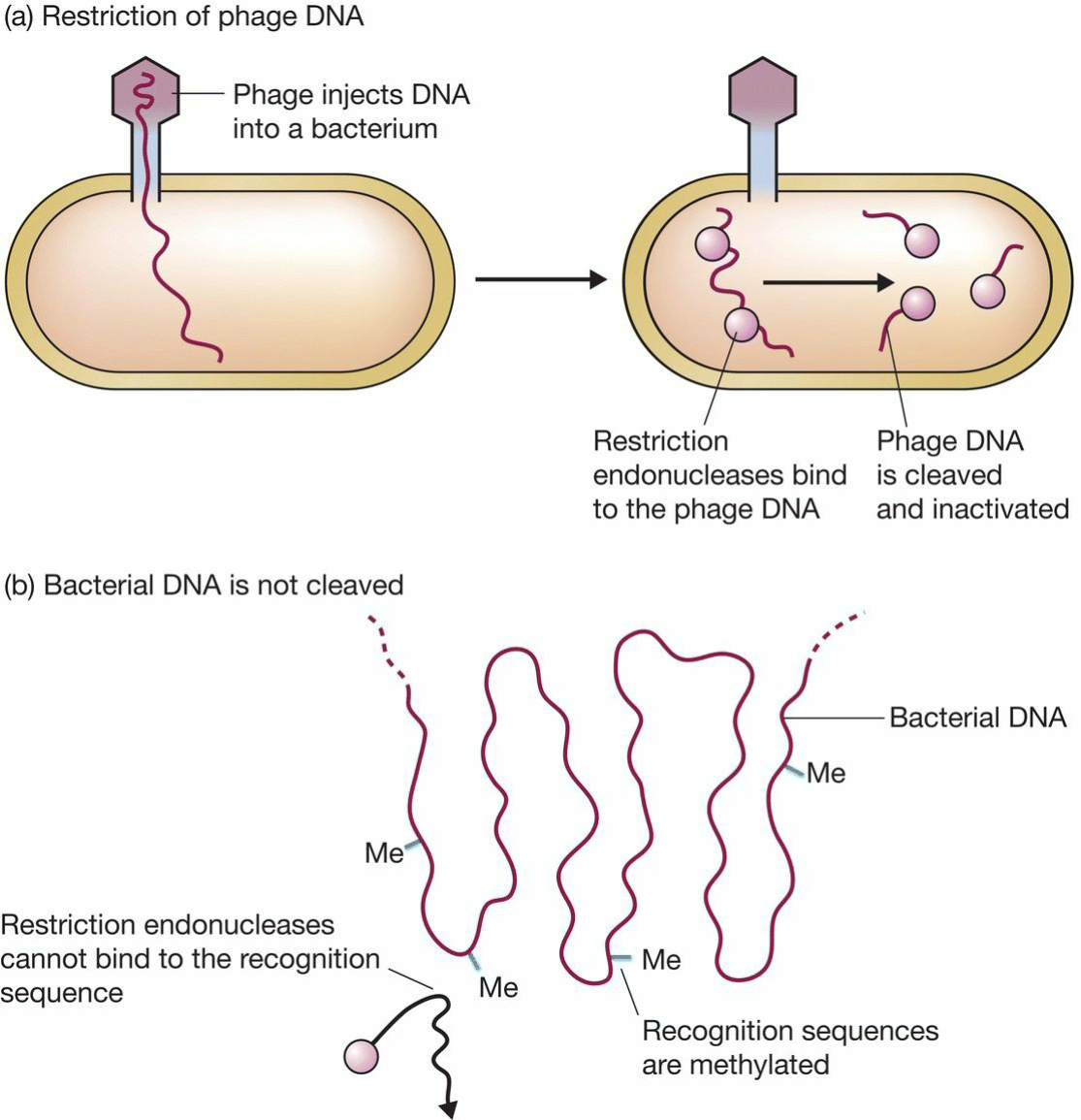
- Host-controlled restriction:宿主细胞能够在噬菌体复制之前切割噬菌体DNA,而细菌自身的DNA受到保护,不会被降解,因为它被甲基修饰。
- II型限制性内切酶在基因克隆中很重要。
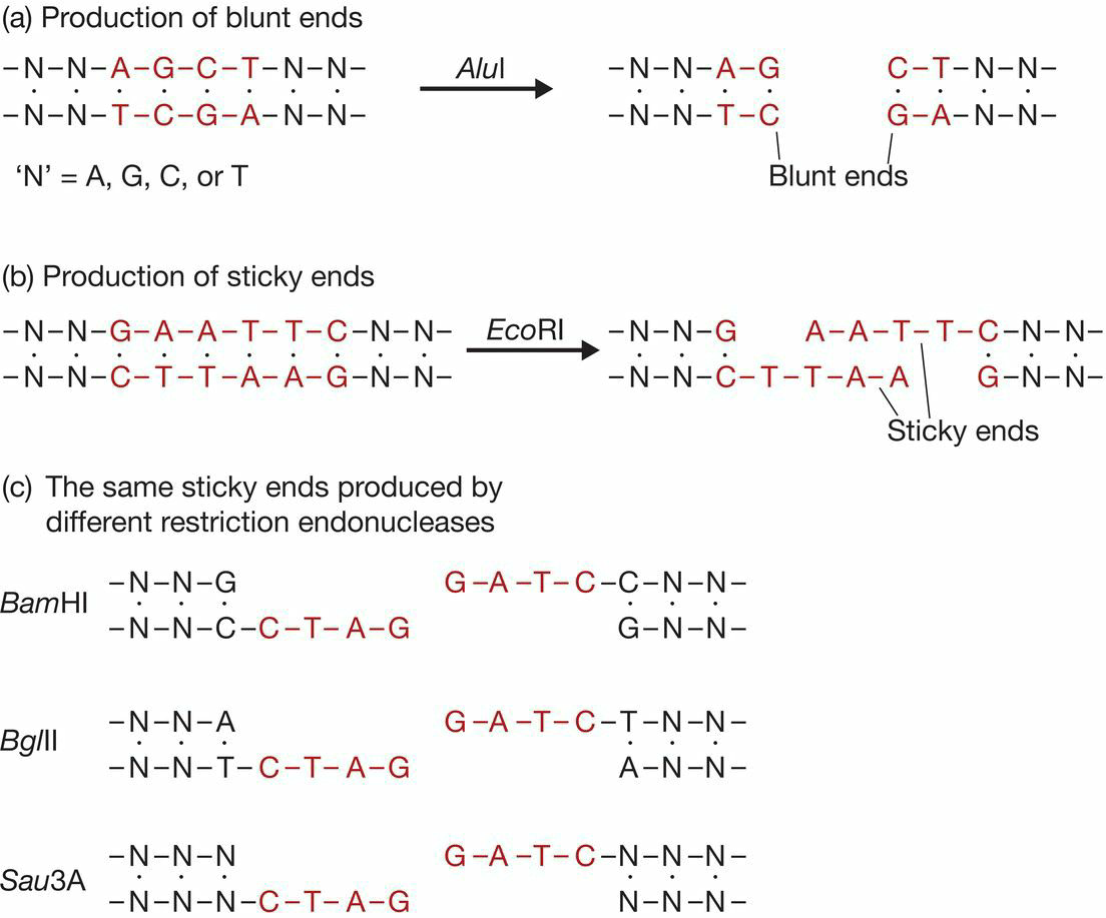
- 识别位点为回文序列;
- II限制性内切酶有相同的亚基,识别的序列必然相同;
- 两亚基位置不平行,故而结合位置有差异, 所以产生粘性末端;
- BamHI和BglII具有相同的粘性末端;
- 还需要注意的是切割出的粘性末端长度:
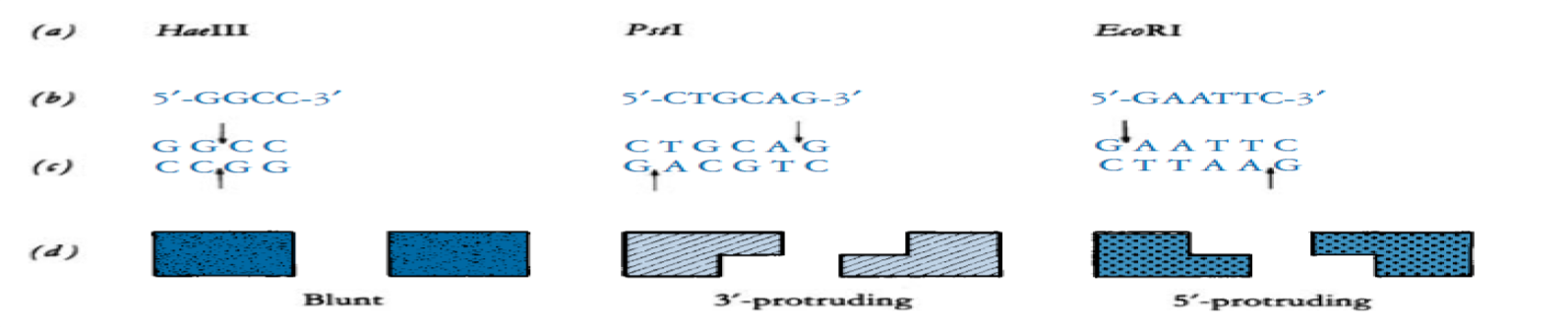
- 如EcoRI,切割”G|AATTC”,但是由于对称结构,左右两边各留出一个核苷酸,粘性末端为”AATT”
- Host-controlled restriction:宿主细胞能够在噬菌体复制之前切割噬菌体DNA,而细菌自身的DNA受到保护,不会被降解,因为它被甲基修饰。
- restriction digest:
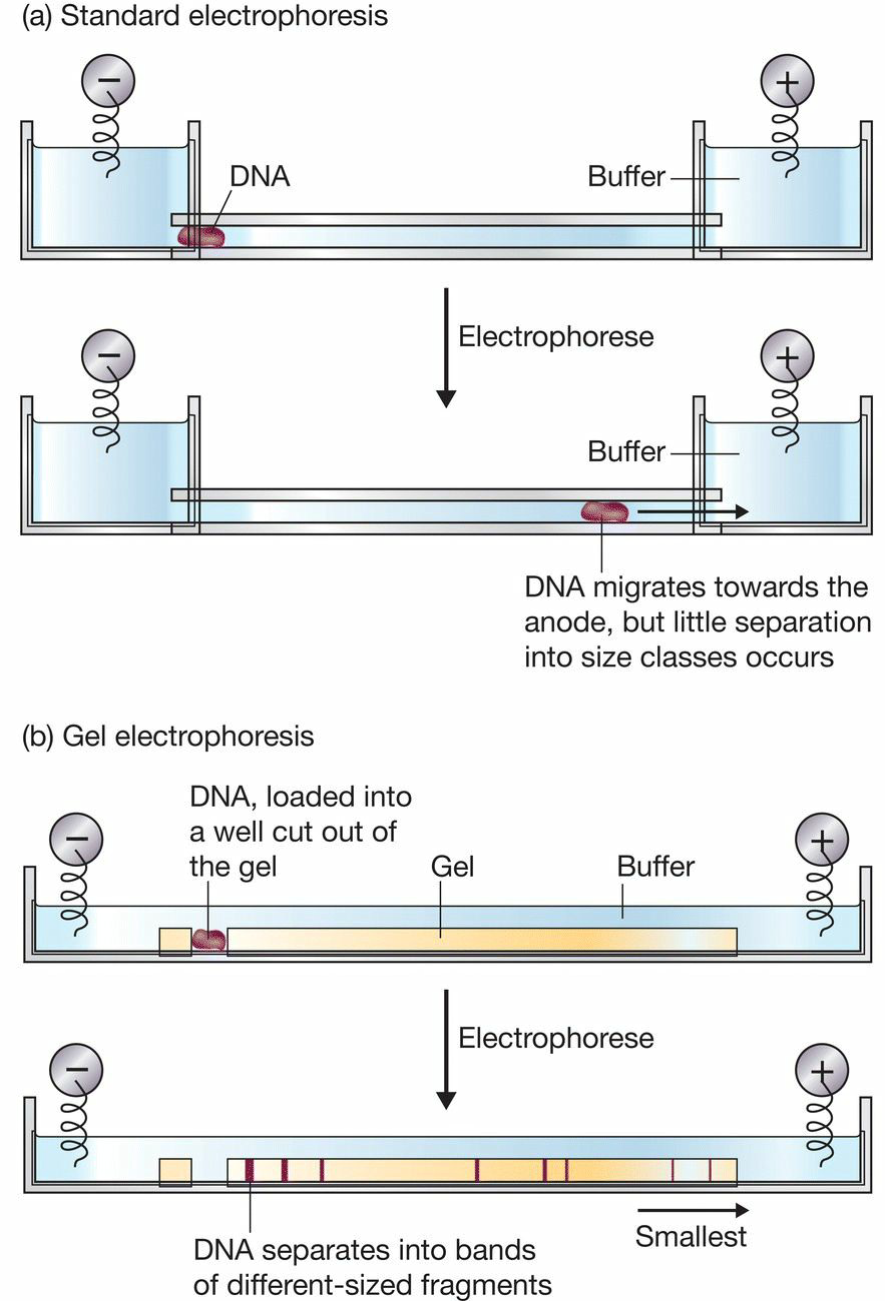
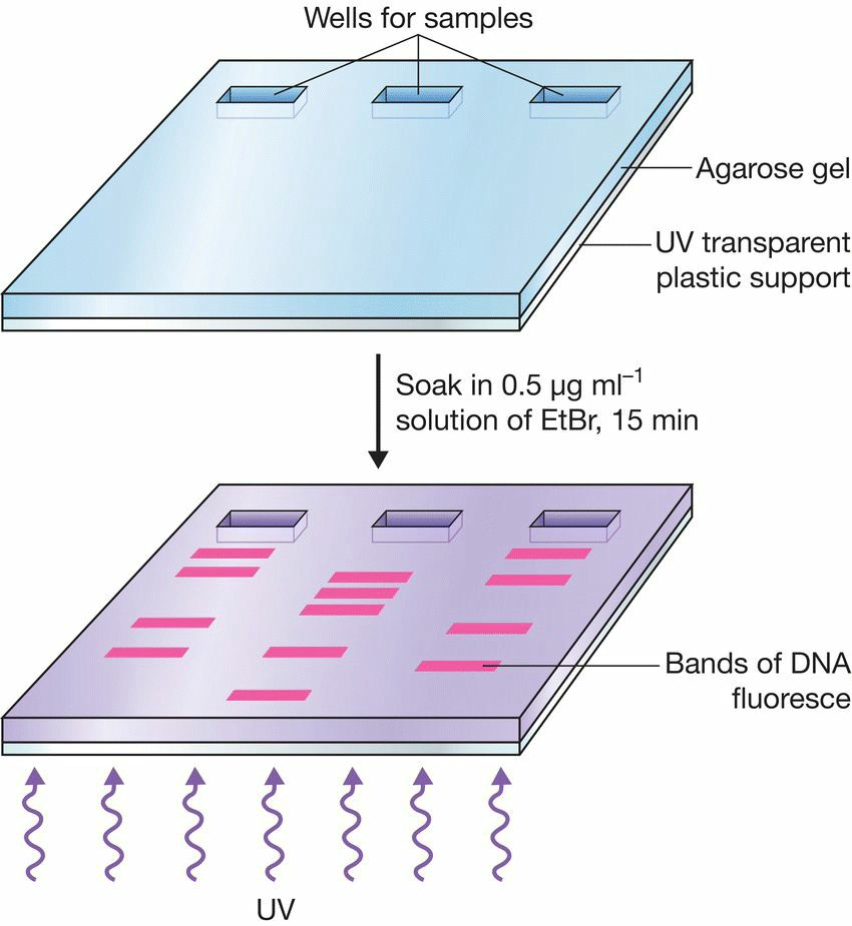
- Ethidium bromide (EtBr):前面说到能够插入DNA双链,同时也能用来给DNA染色;
- DNA分子大小评估:
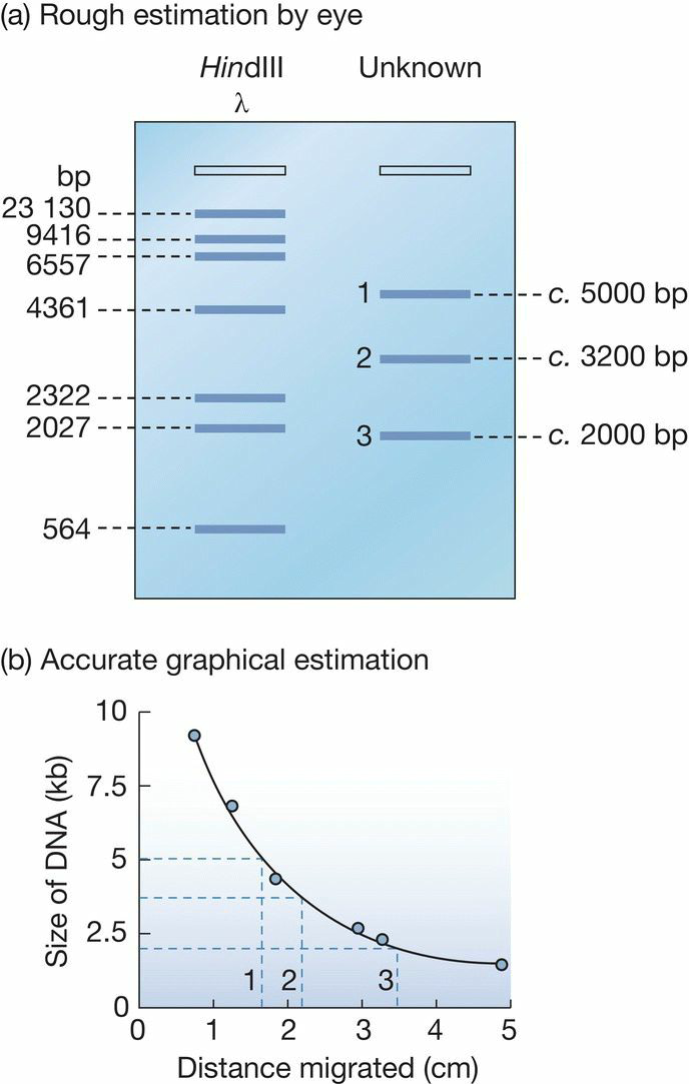
- a size marker;
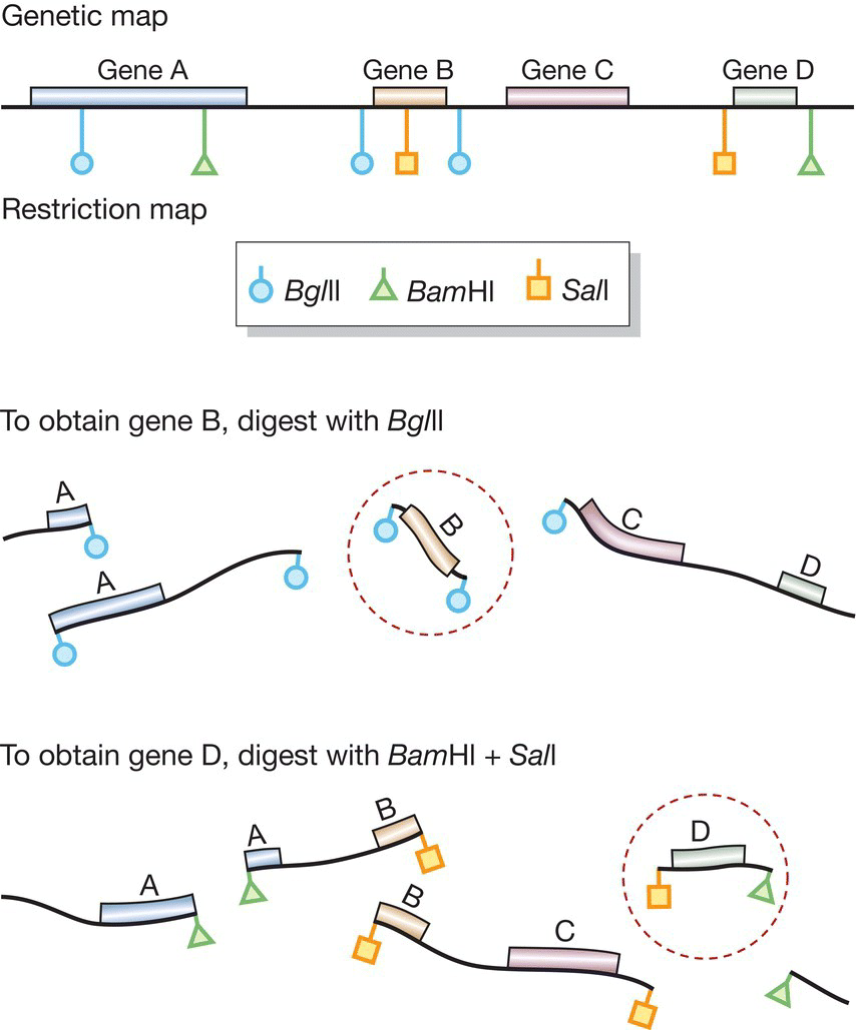
- 使用不同的酶切割获取不同的基因;
- DNA ligation:
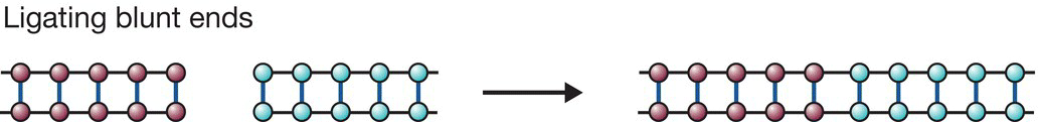
- 互补粘性末端的连接比钝性末端要高效的多;
- Putting sticky ends onto a blunt-ended molecule:
- Linkers
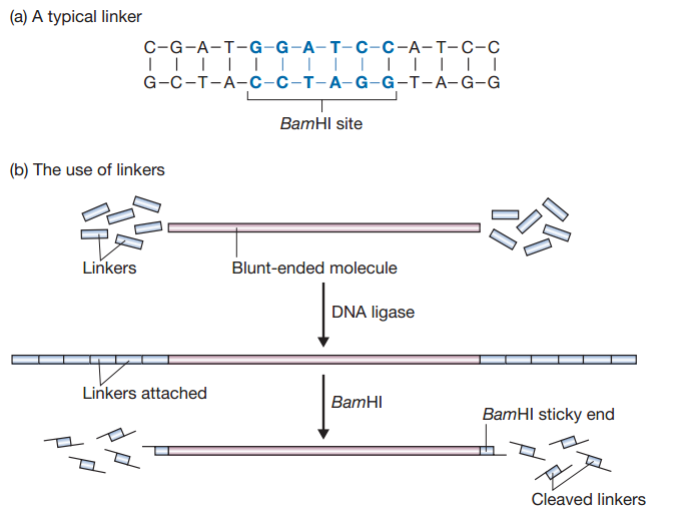
- There should not be any BamHI recognition site in the fragment!
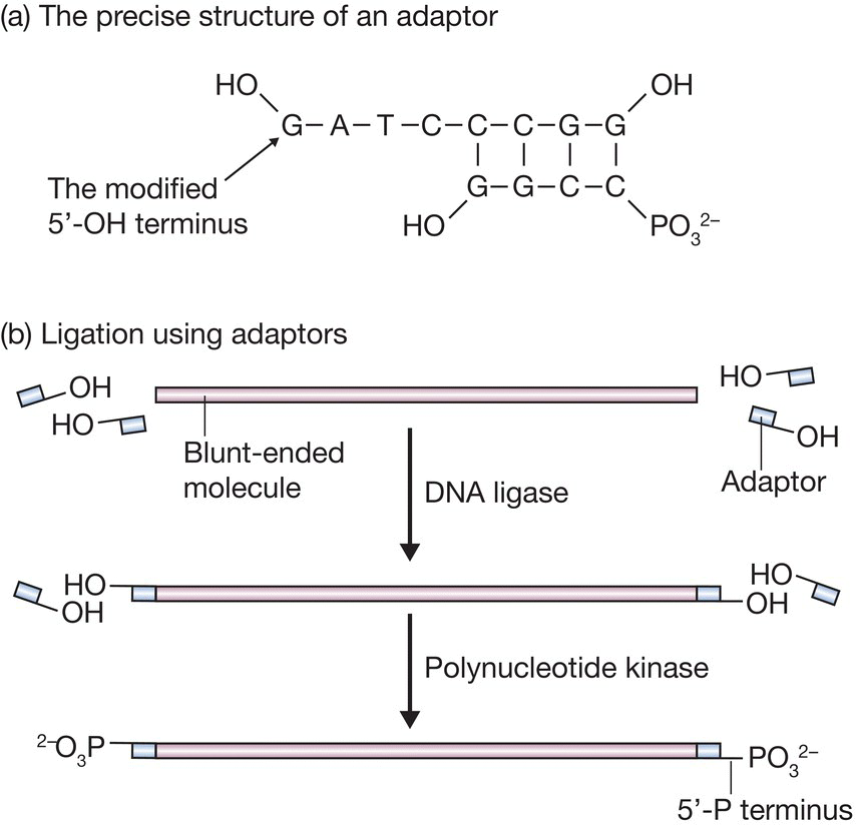
- Adaptors
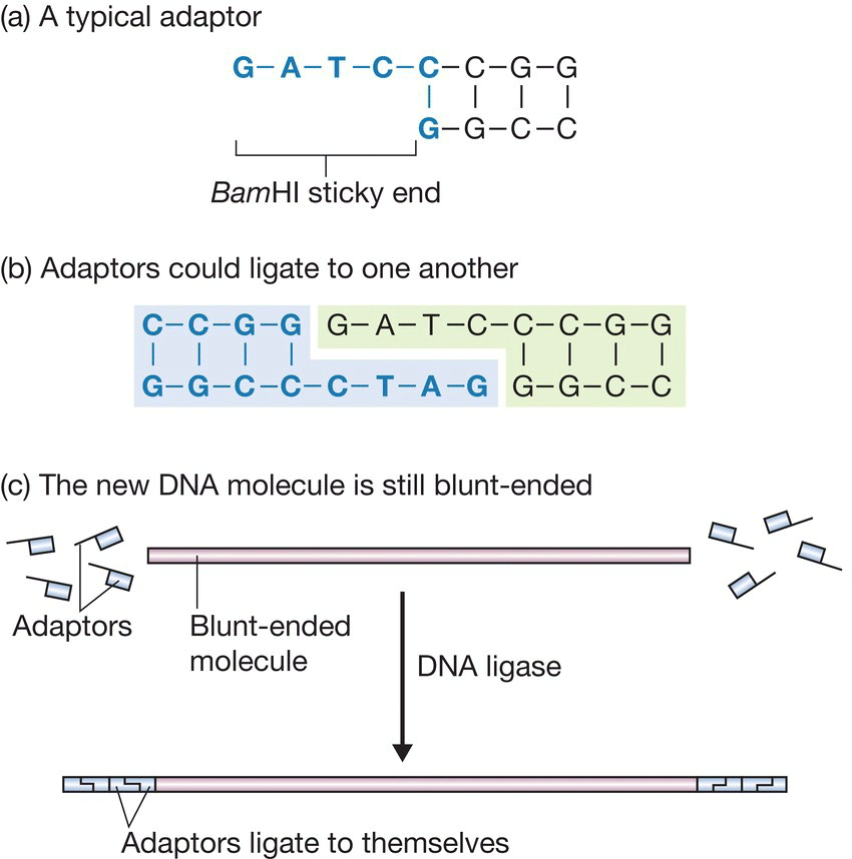
- 实际上是带有粘性末端的片段;
- Part c是可能的问题:adaptor相互连接;
- 解决办法:将粘性末端突出链(5’端)的磷酸基团去除,从而无法互相结合
- Producing sticky ends by homopolymer tailing
- Terminal deoxynucleotidyl transferase:末端转移酶,见上文 DNA modifying enzymes;能够往3’端添加核苷酸;
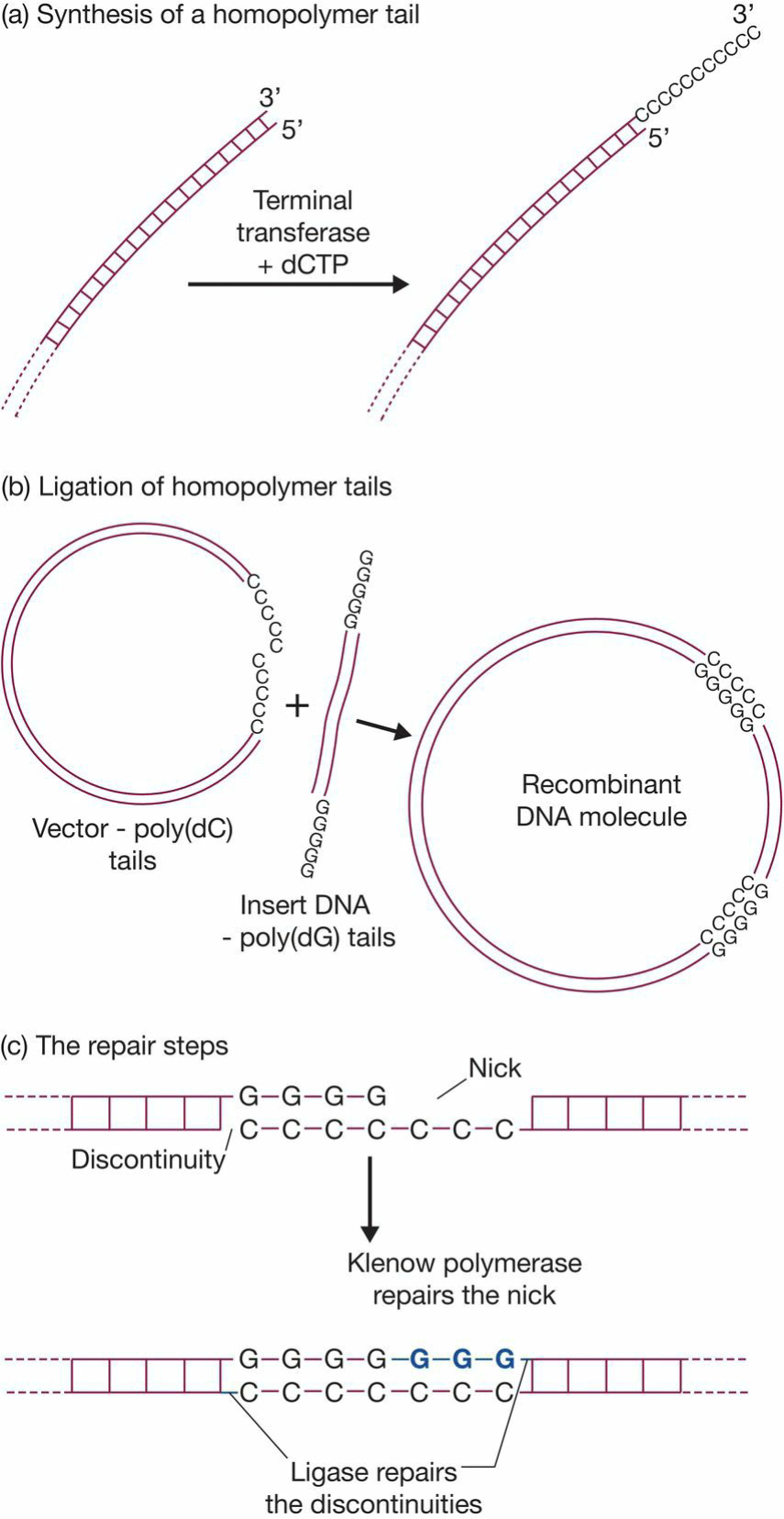
- 目的基因加poly C,载体加poly G,结合稳定;
- polymer长度不同的问题: Klenow polymerase+ligase
- Linkers
- 互补粘性末端的连接比钝性末端要高效的多;
Introduction of DNA into Living cells
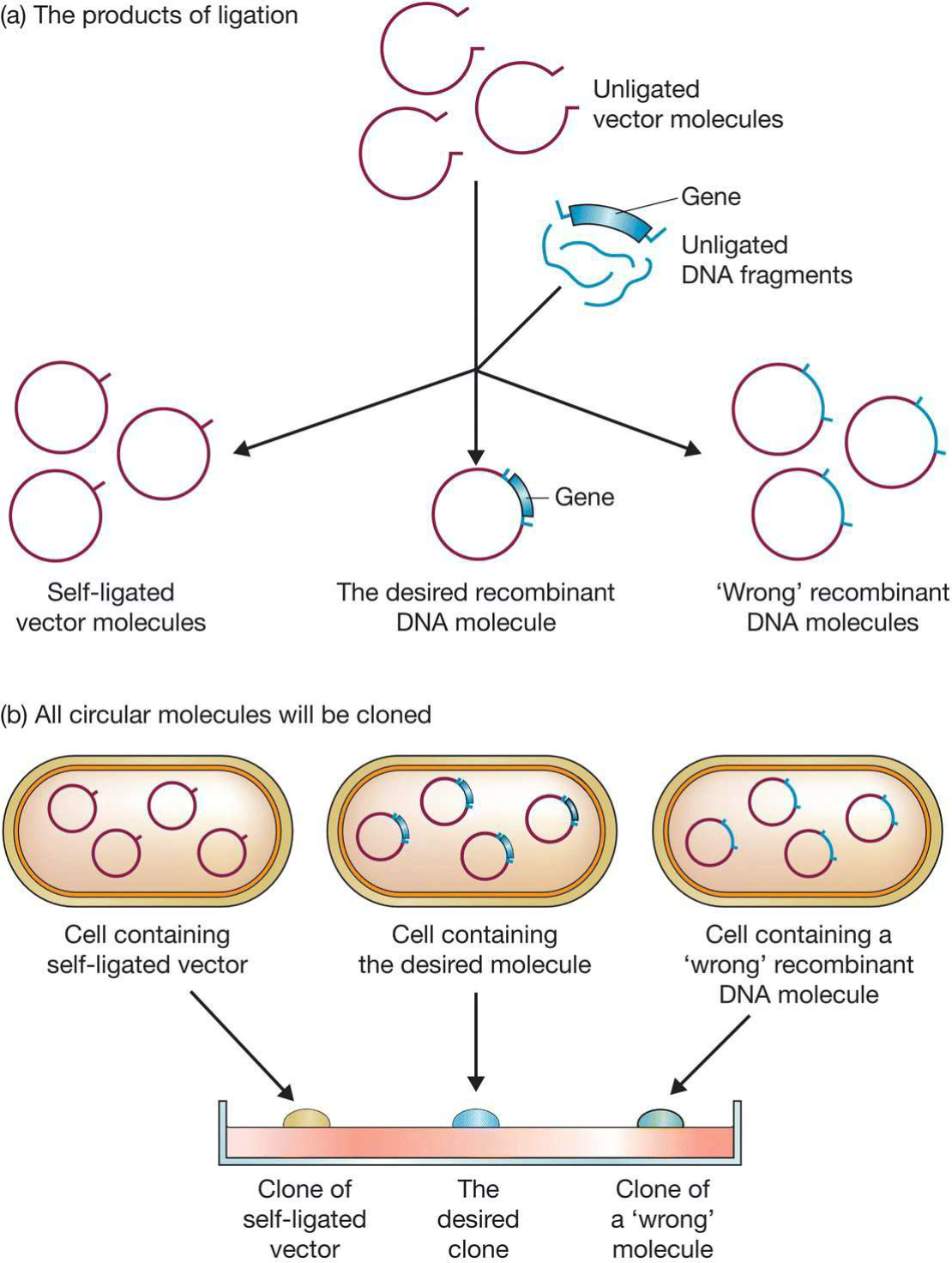
- 未连接的载体
- 未连接的DNA
- 自体连接的载体
- 携带错误片段的分子
[质粒DNA引入]Transformation:the introduction of any DNA molecule into any living cell.
- 只有少部分物种能够轻松转化;
- 大肠杆菌只吸收少量DNA;
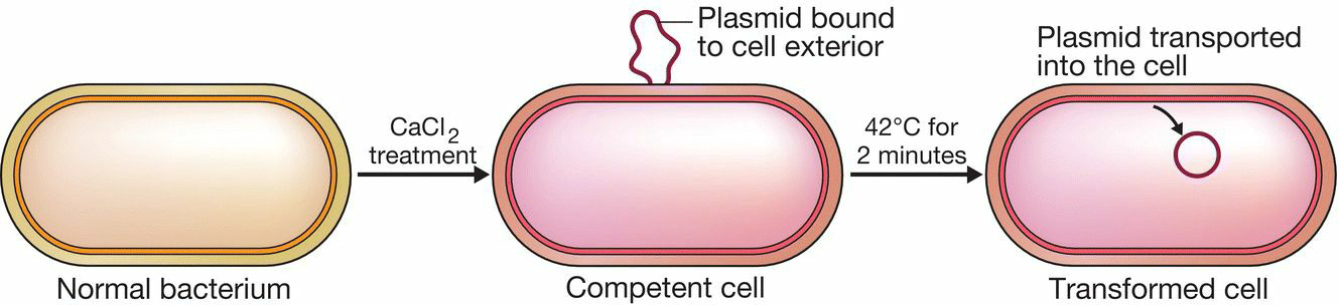
- 大肠杆菌需要化学或者物理处理使得其competent;
- competent: DNA吸收能力增强的细菌培养物;
- Competent treatment:
- calcium chloride($CaCl_2$)溶液,低温处理;
- 氯化钙能使DNA沉积于细胞表面;
- 同时造成细胞膜产生物理变化(如打出孔)
- 将温度提升到42°C,使得DNA被吸收
- 检测是否吸收完成|稳定:通过判断某些基因是否表达(如表达青霉素抗性的基因)
- Select transformed cells:
- 1 ng pUC8质粒只能够产生100-10000个转化体, 仅为总DNA分子数的0.01%,故而要经过挑选;
- 抗生素选择:
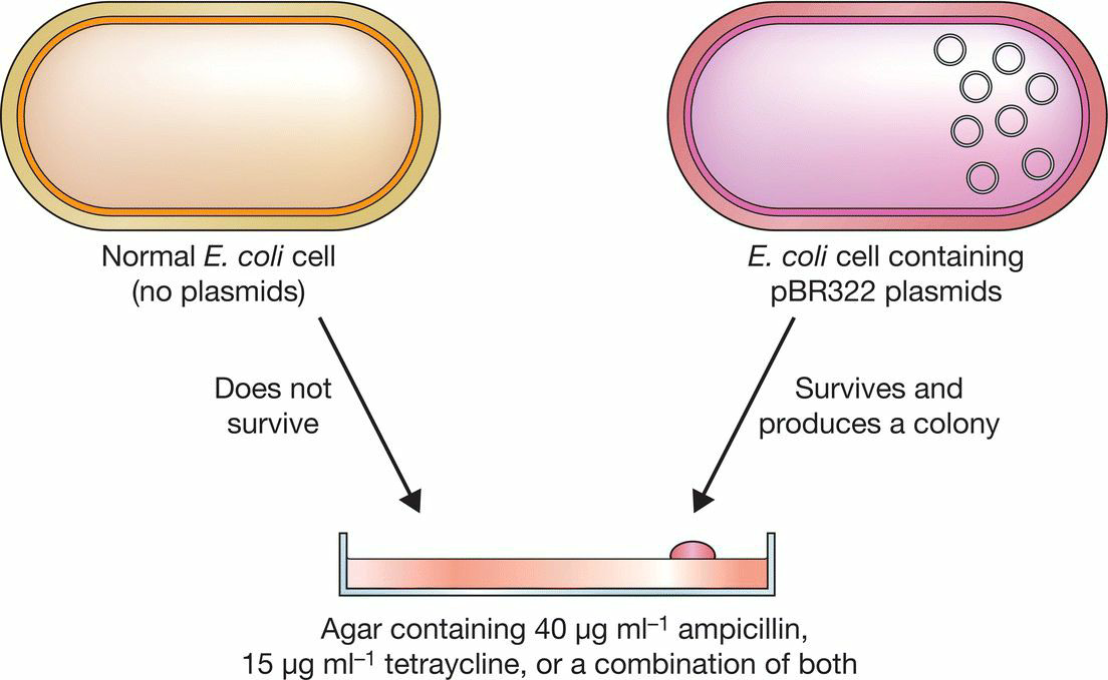
- 用共有抗性 amp 筛选出载体分子和重组分子(不含载体的被筛去);
- 需要37°C培养1小时以让抗性基因表达;
- Recombinant identification
- 插入失活:正常表达的载体含有的选择性标签由于目的基因的插入而失活;
- 插入后原本表达的特征不表达;
- 抗生素抗性基因选择(pBR22):
- pBR22携带四环素和青霉素抗性[BamHI插入]
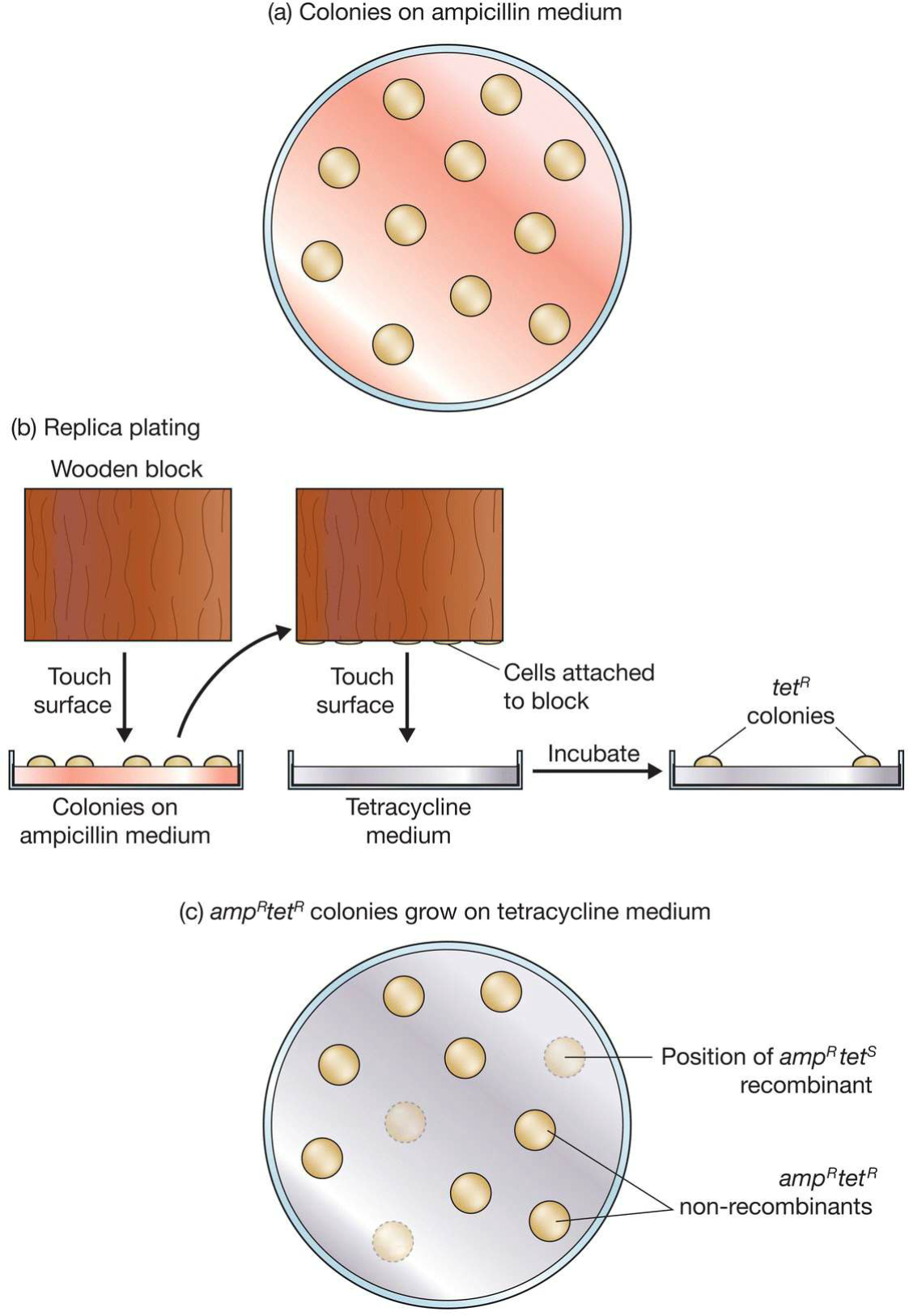
- 用木板记录下菌落位置,并按位置移植到$tet^R$培养基中,重组分子由于插入失活从而无法生长, 在第一个中取反即可得知重组分子菌落位置;
- lac基因选择(pUC8):
- pUC8携带青霉素抗性基因[BamHI插入]
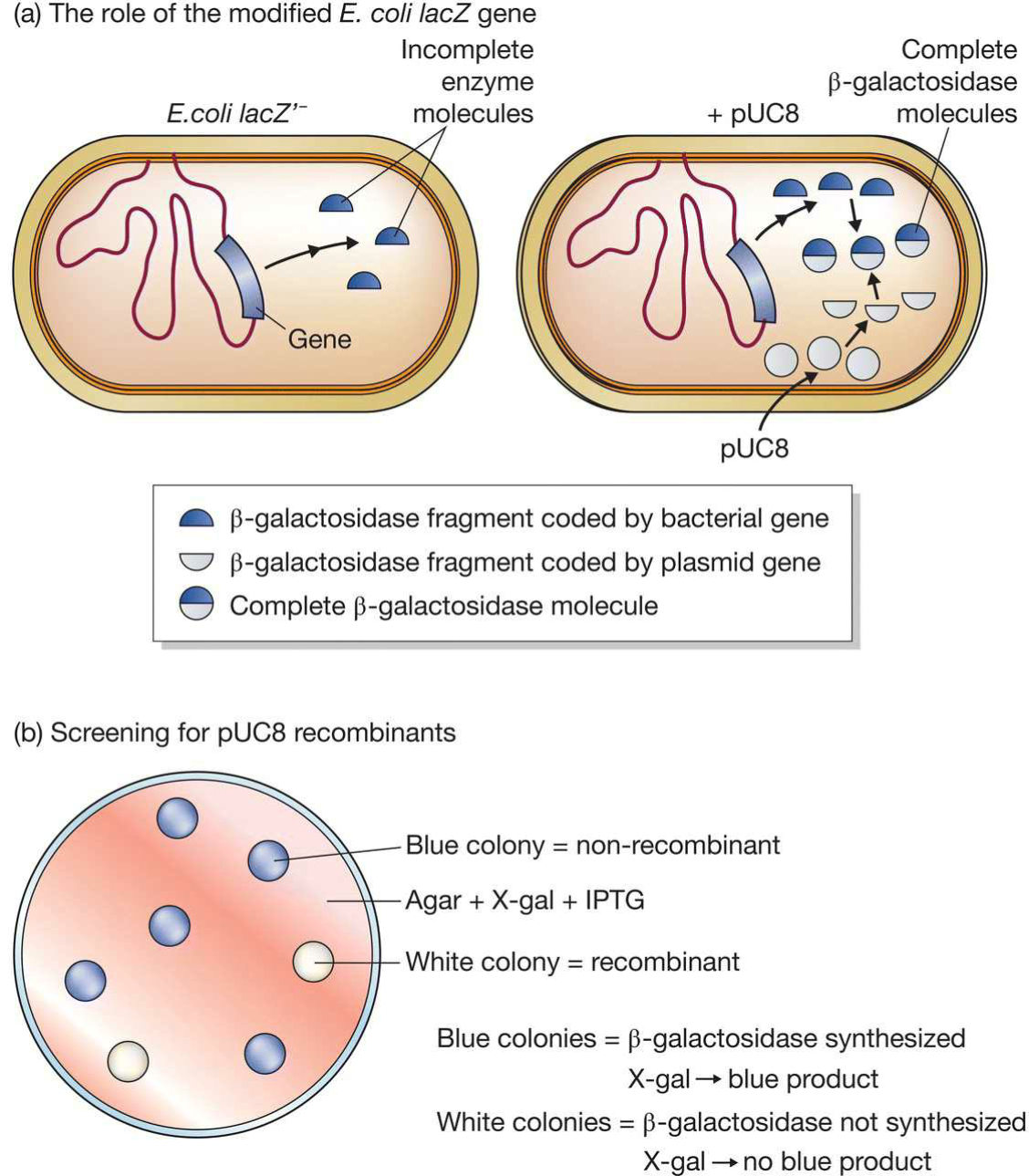
- 半乳糖苷酶由两部分组成:一部分由宿主编码(编辑过的大肠杆菌,缺失了编码lacZ’的部分),另一部分由质粒表达,组合成全酶;
- X-gal:乳糖类似物,被半乳糖苷酶分解生成深蓝色产物;
IPTG: 在没有乳糖存在时,lac操纵子(元)处于阻遏状态。此时,I序列在PI启动序列操纵下表达的Lac阻遏蛋白与O序列结合,阻碍RNA聚合酶与P序列结合,抑制转录启动。当有乳糖存在时,lac操纵子(元)即可被诱导。在这个操纵子(元)体系中,真正的诱导剂并非乳糖本身。乳糖进入细胞,经β-半乳糖苷酶催化,转变为异乳糖。后者作为一种诱导剂分子结合阻遏蛋白,使蛋白构象变化,导致阻遏蛋白与O序列解离、发生转录。异丙基硫代半乳糖苷(IPTG)的作用与异乳糖相同,是一 种作用极强的诱导剂,不被细菌代谢而十分稳定,因此被实验室广泛应用。
- 由于recombinants中的lac基因被插入失活,故而无法合成半乳糖苷酶片段,无法分解X-gal,呈现白色;
- 插入失活:正常表达的载体含有的选择性标签由于目的基因的插入而失活;
- [噬菌体DNA引入]transfection&in vitro packaging:
- transfection: equivalent to transformation;
- M13双链的RF形式DNA导入
- in vitro packaging:
- λ噬菌体转染效率低,使用in vitro packaging方法;
- capsid 蛋白准备:
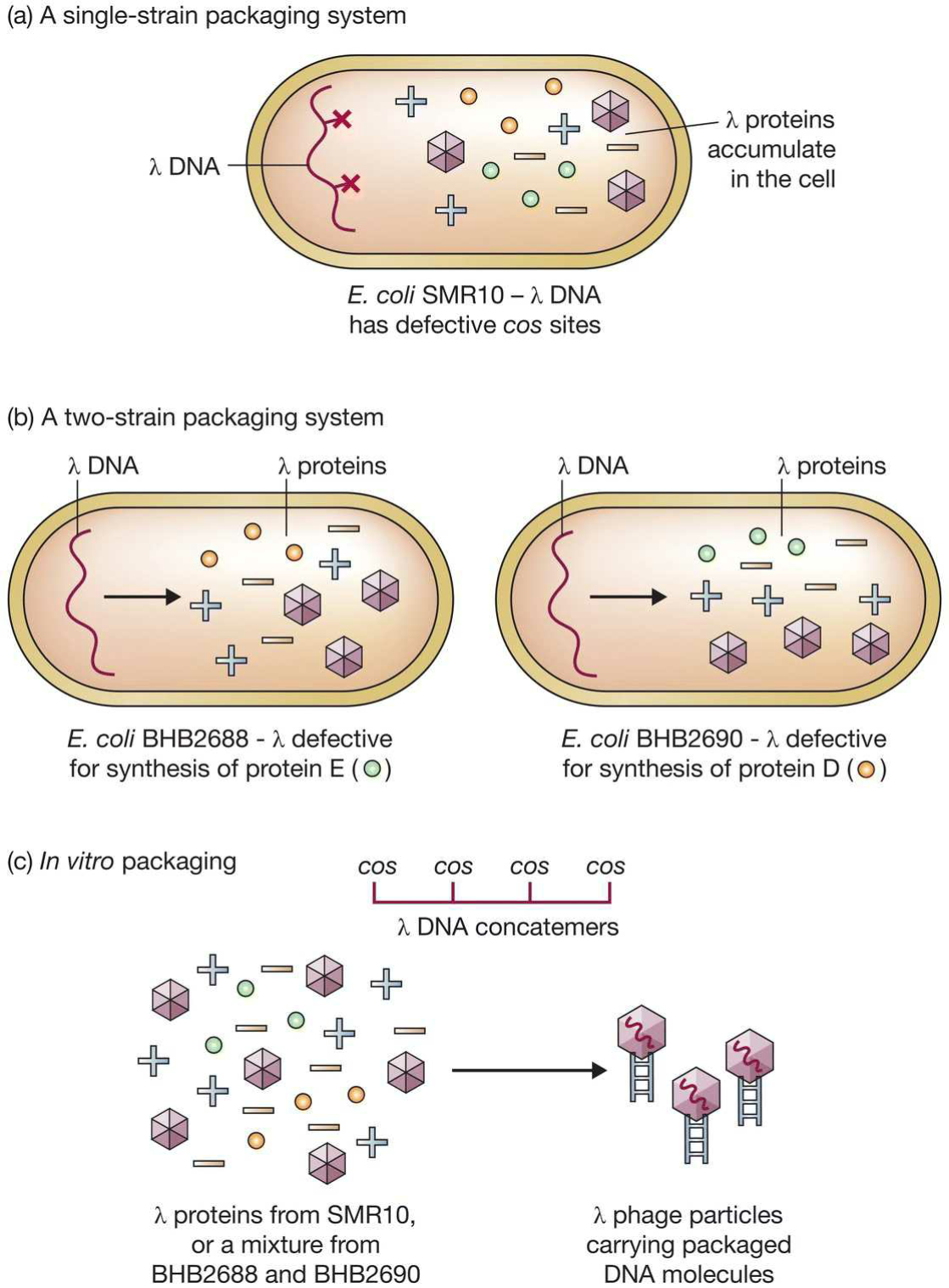
- 系统1: 缺陷cos位点,cos位点无法被识别, 致使λ噬菌体无法复制(滚环需要环状DNA),但是能够合成蛋白;
- 系统2:有两个重组, 两个所携带capsid基因中分别有一个突变,生成的蛋白不全,故而无法独立完成感染循环,将之混合后能够进行组装从而获得噬菌体.
- 噬菌斑:
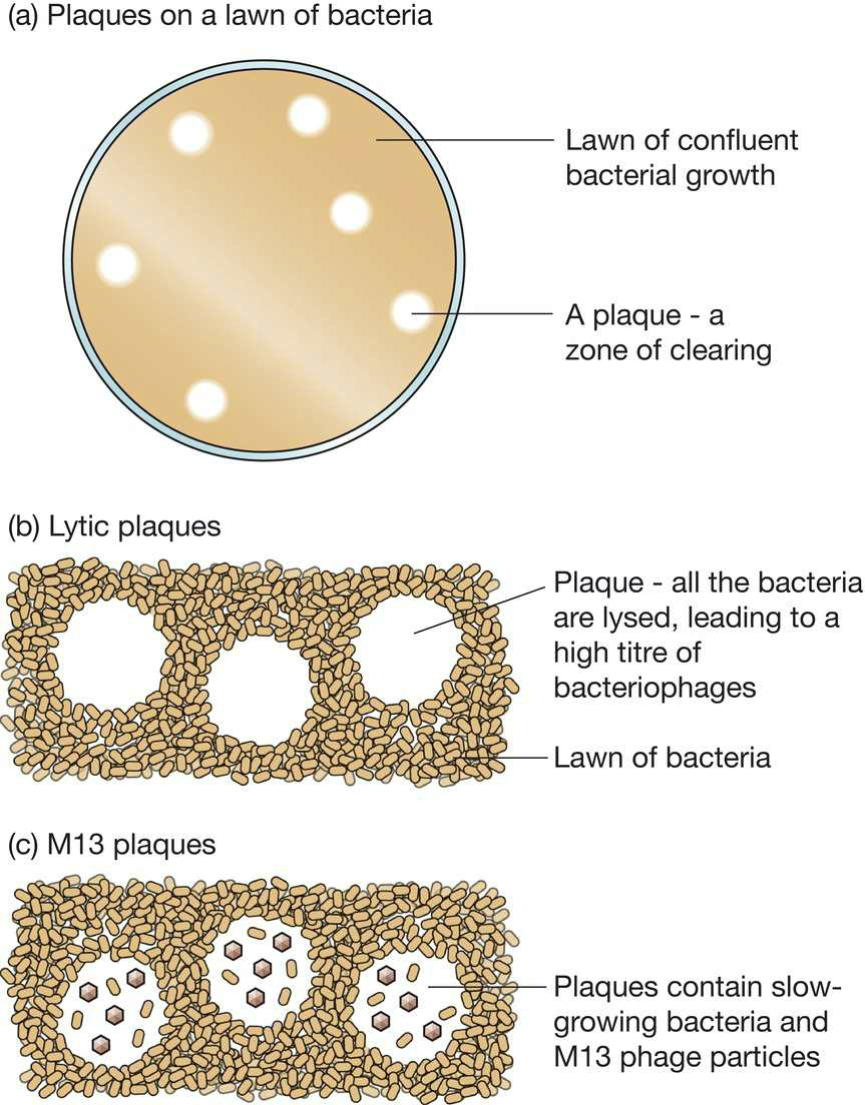
- 对于λ噬菌体:包含裂解的宿主细胞和噬菌体颗粒;
- 对于M13:包含生长缓慢的细菌和M13颗粒;
- 每个噬菌斑来自于单个感染的细胞;
- 可能是recombinants,也可能是self-ligated vectors;
- Select recombinant phages:
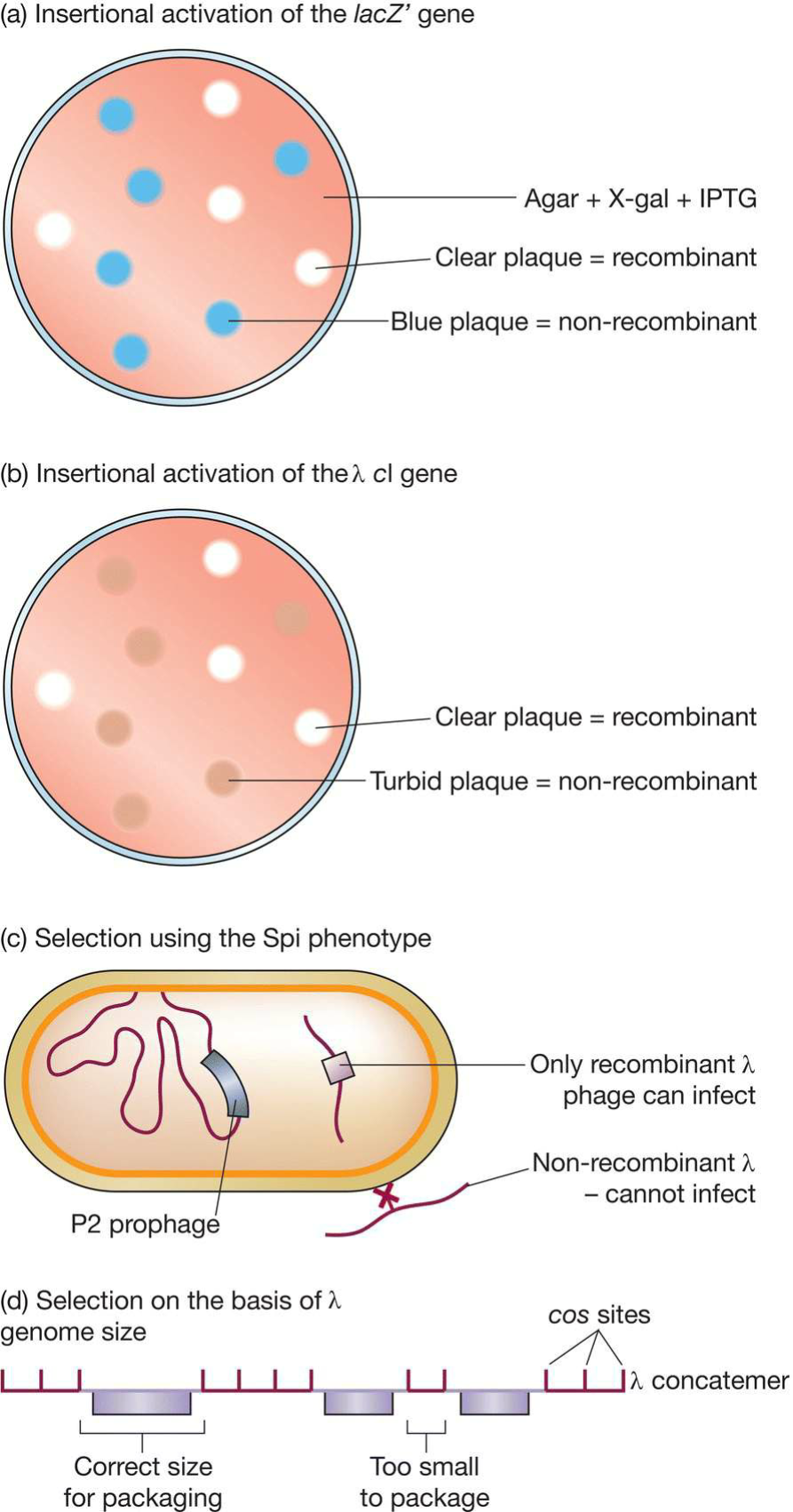
- lac基因插入失活:recombinant的噬菌斑不是white,而是clear!
- λ cI基因插入失活:non-recombinant的cI基因正常工作,形成lysogen,故而呈现浑浊噬菌斑;
- Spi表型:λ噬菌体不能感染P2噬菌体已经感染的大肠杆菌,称之为$Spi^+$;
- 插入新的DNA能够使λ转变为$Spi^-$,从而能够形成噬菌斑[也只有重组型可以];
- transfection: equivalent to transformation;
Cloning Vectors for E.coli
- 经典质粒:
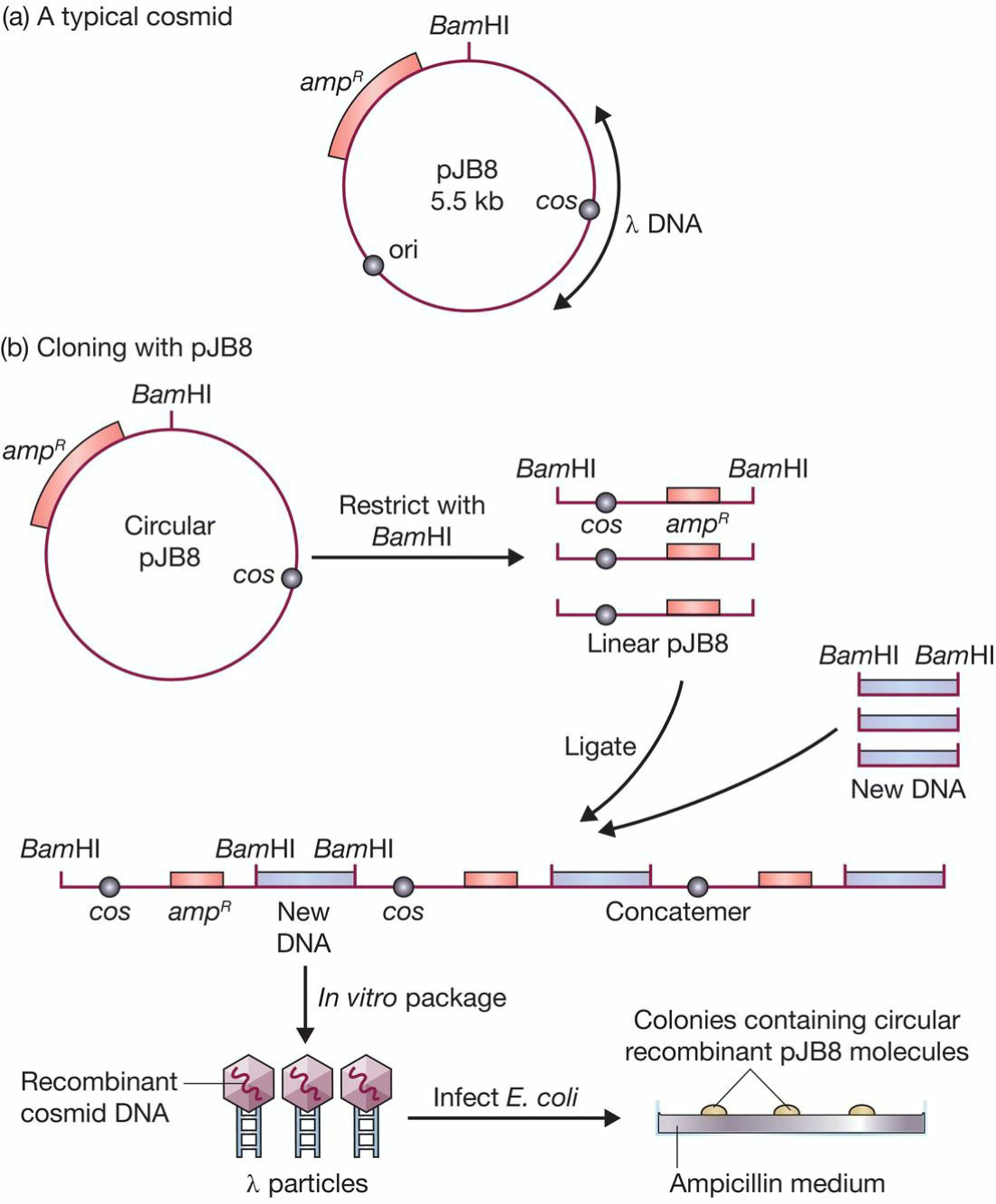
- pBR322
- 4363bp大小,体积小;
- 青霉素和四环素抗性基因;
- 15copies, 高拷贝数;
- pBR327
- 比pBR22更高的拷贝数(30-45copies)
- pUC8
- 500-700copies;
- 青霉素抗性基因+lac’基因,能够完成重组体选择
- lac’基因上有一簇限制性位点,允许DNA片段两不同粘性末端;
- pGEN3Z
- 青霉素抗性基因+lac’基因
- 含有两promoter序列在lac’基因的两端,可以用于体外转录,从而允许双向转录;
- pBR322
- 噬菌体载体:
- lambda噬菌体:
- 大小问题: 噬菌体衣壳大小有限,能放入的DNA长度有限;
- solution: 将无重要功能的b2区去除从而省出空间;
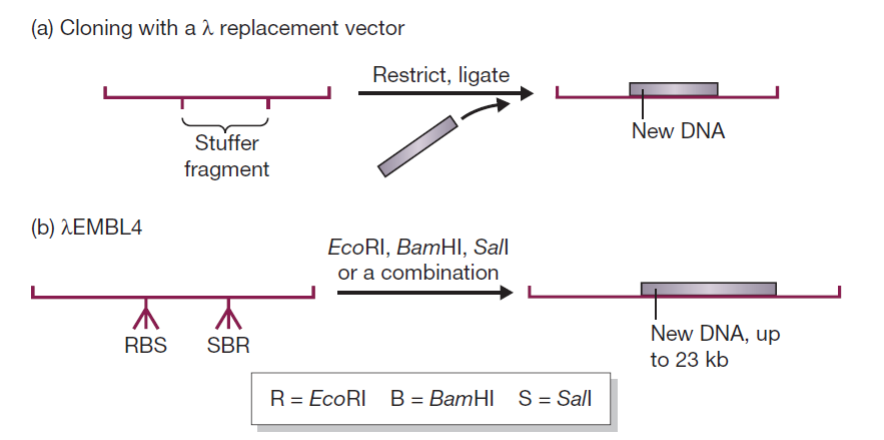
- 酶切位点问题:λ噬菌体有多个酶切位点(甚至对于同一个限制酶);
- solution: 将分泌限制酶的E.coli突变体用λ噬菌体感染,如果只有产生突变的,去除了限制位点的噬菌体能形成噬菌斑;
- 绝大部分的λDNA被降解, 少数剩下的(产生plaque)丢失了限制位点;
- 种类:
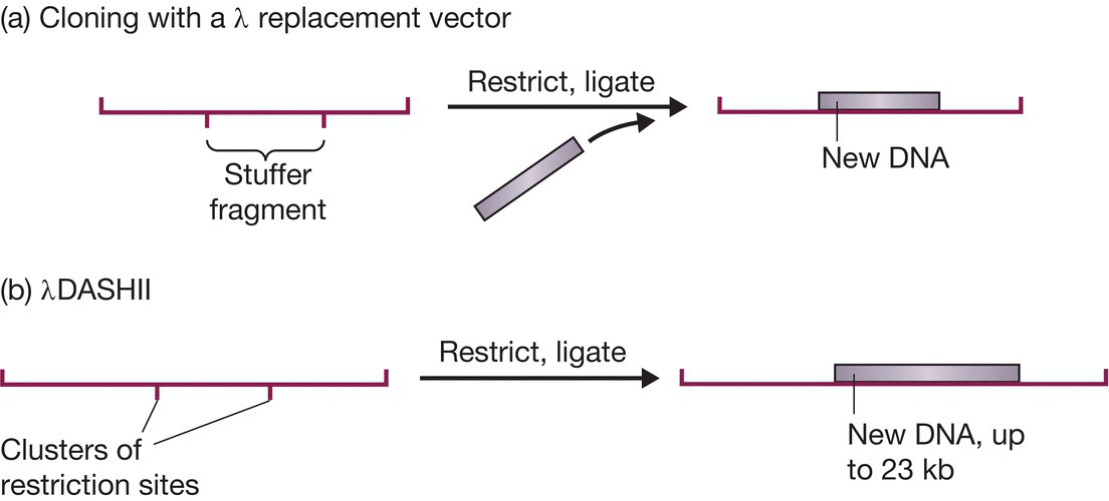
- λ insertion vector:去除b2区得到,存在一个酶切位点;
- 普通λ基因组只能增加5%的DNA,也即3kb,否则放不进capsid,去除非必要区后,容量大大增加;
- λgt10:CI基因能够保持基因组在Prophage状态,含有EcoRI限制位点, 基因插入失活,从而产生clear plaque;携带8kb
- λ ZAPII:含有lacZ’基因,故而能够允许插入失活,并含有6个限制性位点;
- replacemnet vector替换型载体: 含有一个stuffer区, 能够通过限制性位点替换掉Stuffer fragment;携带10kb;
- λ insertion vector:去除b2区得到,存在一个酶切位点;
- 大小问题: 噬菌体衣壳大小有限,能放入的DNA长度有限;
- λ噬菌体既可以用环状DNA以质粒形式转染,也可以使用liner形式(含有EcoRI和cos位点)
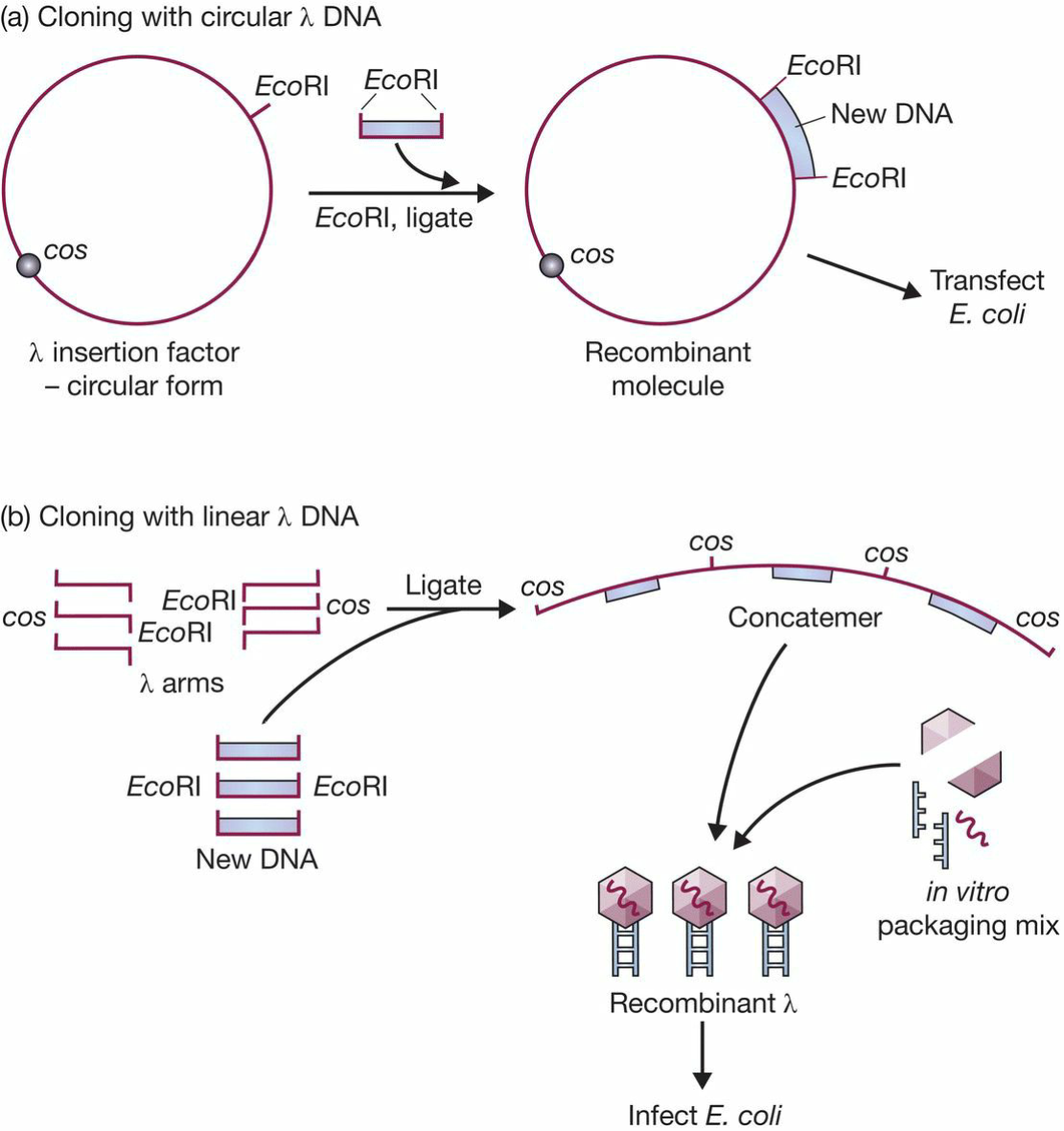
- cosmid : a plasmid that carries a cos site;
- lambda噬菌体:
- 所需的克隆数:N
- $\rho$ = 在基因文库中gene of interest出现的概率;
- $a$ = 插入片段的大小
- $b$ = 基因组总大小;
- M13噬菌体:
- 由于M13基因组基因相隔很近, 修改或者是删除这些基因将会导致RF的功能受阻,只有508个碱基的修改不会影响, 也即是复制起始位点所在区;
- 插入lacZ’到起始位点后面的流程:
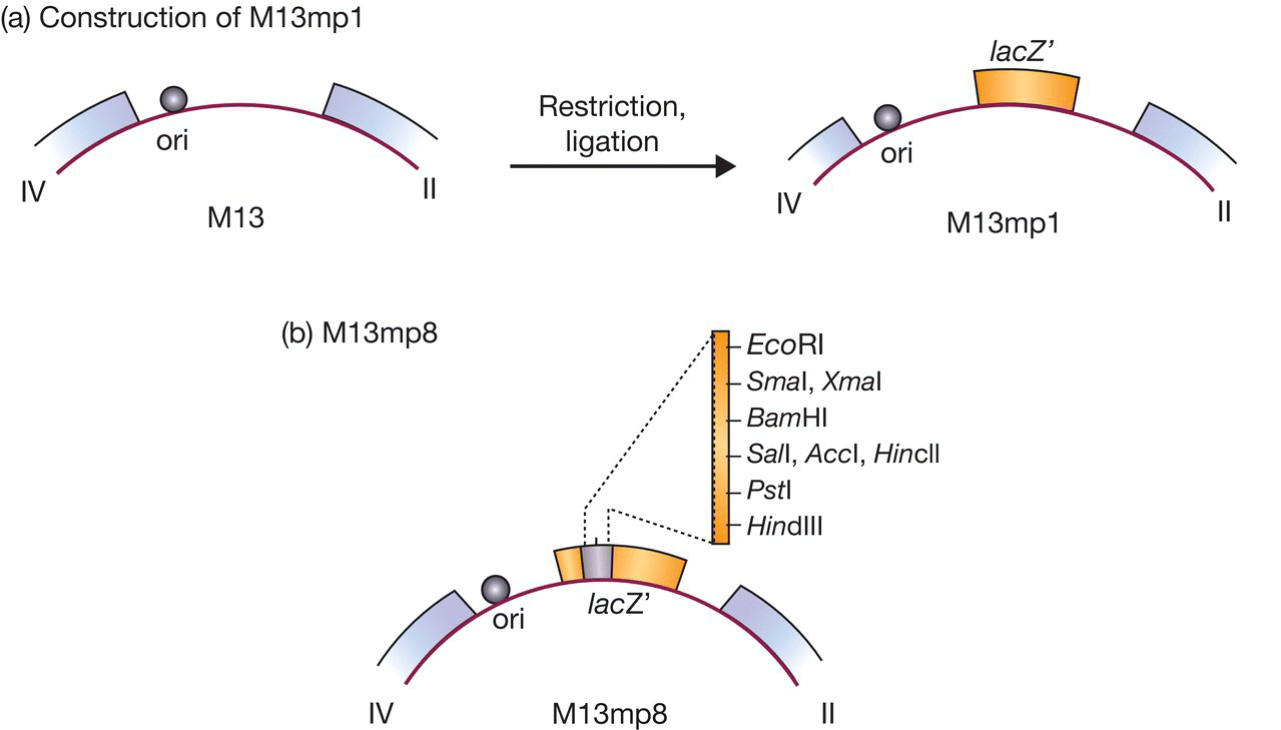
- 怎么做到将限制性位点插入lacZ’?
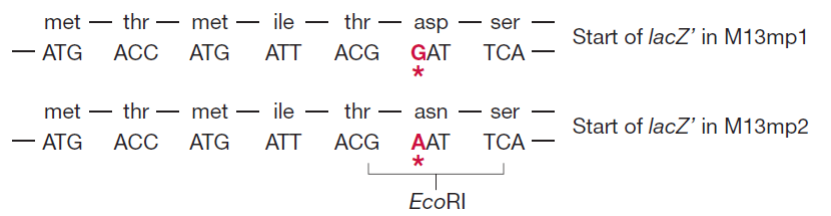
- 首先利用密码子的简并性, 突变得到EcoRI位点同时不改变lacZ’的功能;
- 接着将两端有EcoRI粘性末端的polylinker(携带多个限制位点)插入lacZ’的限制位点;
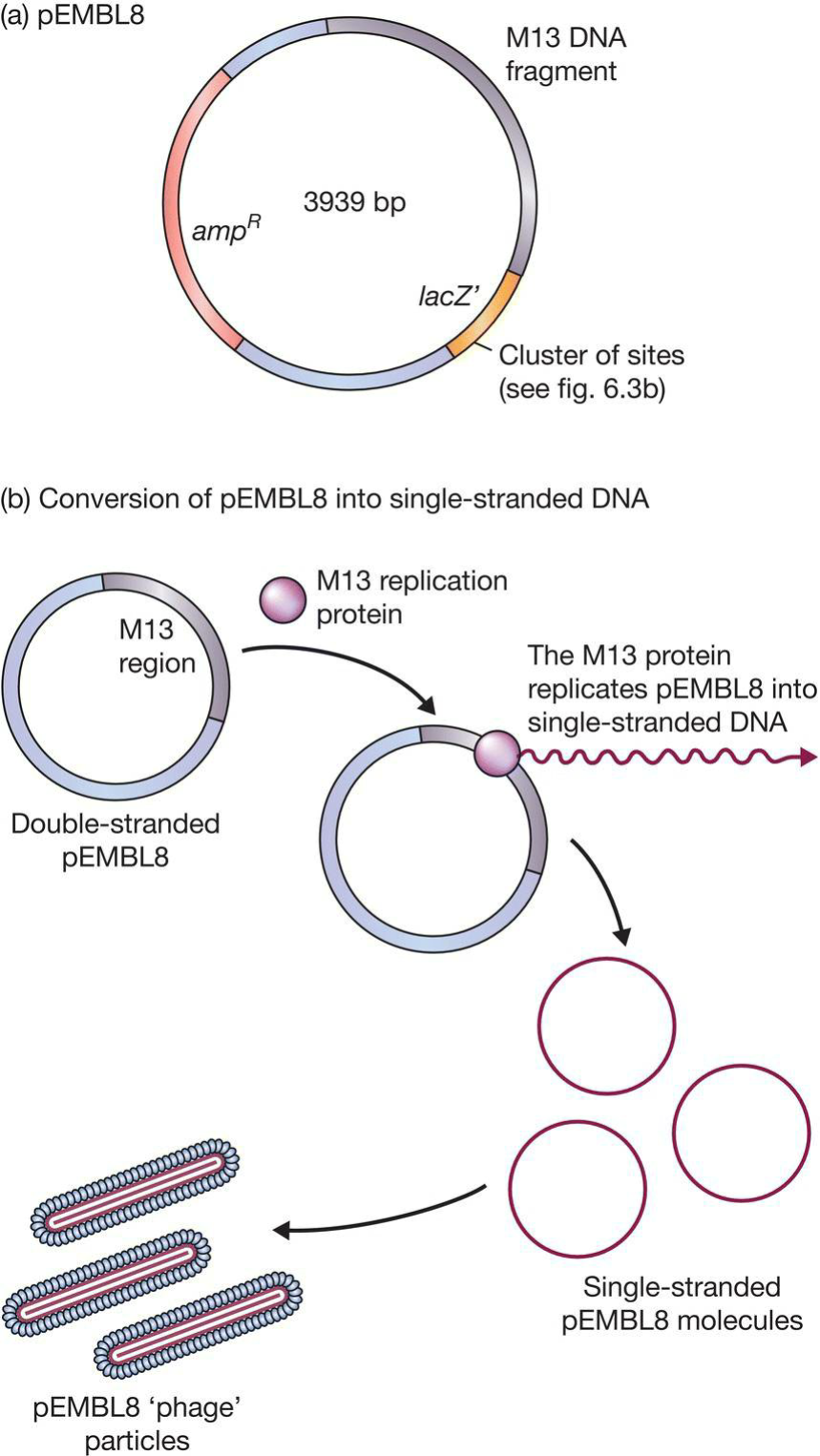
- Hybrid plasmid-M13 vectors (phagemids):杂交M13和质粒:
- 将M13的一部分DNA(形成RF的基因)导入pUC8从而使得质粒能像M13一样进行;
Cloning vectors for Eukaryotes
- 出于某些特殊目的, 我们可能需要使用真核生物作为宿主:
- 为了获得大量药用蛋白;
- 为了改变某个生物的性质,如为农作物添加除草剂抗性;
- 真菌载体(酵母):
- 2 μm plasmid:
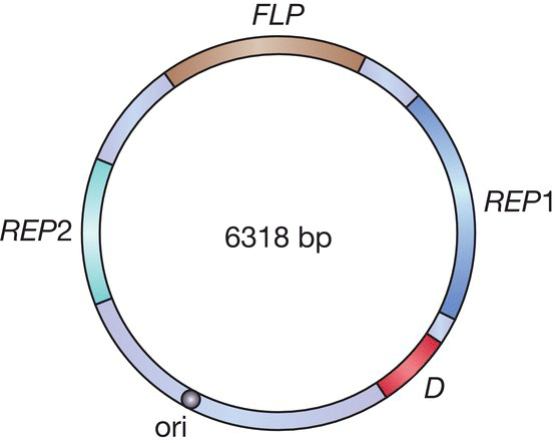
- REP1 and REP2 are involved in replication of the plasmid.
- FLP: 编码能够使质粒内重组的蛋白;
- copy numbers:70-200
- selective marker:
- LEU2: 编码将丙酮酸转化为亮氨酸的酶, 对于trp-营养缺陷型的宿主来说是必要的,故而以之作为宿主,再使用含LEU2的载体从而得到recombinant;
- 其他的marker也类似,主要是使用缺陷型;
- 克隆载体:
- 种类:
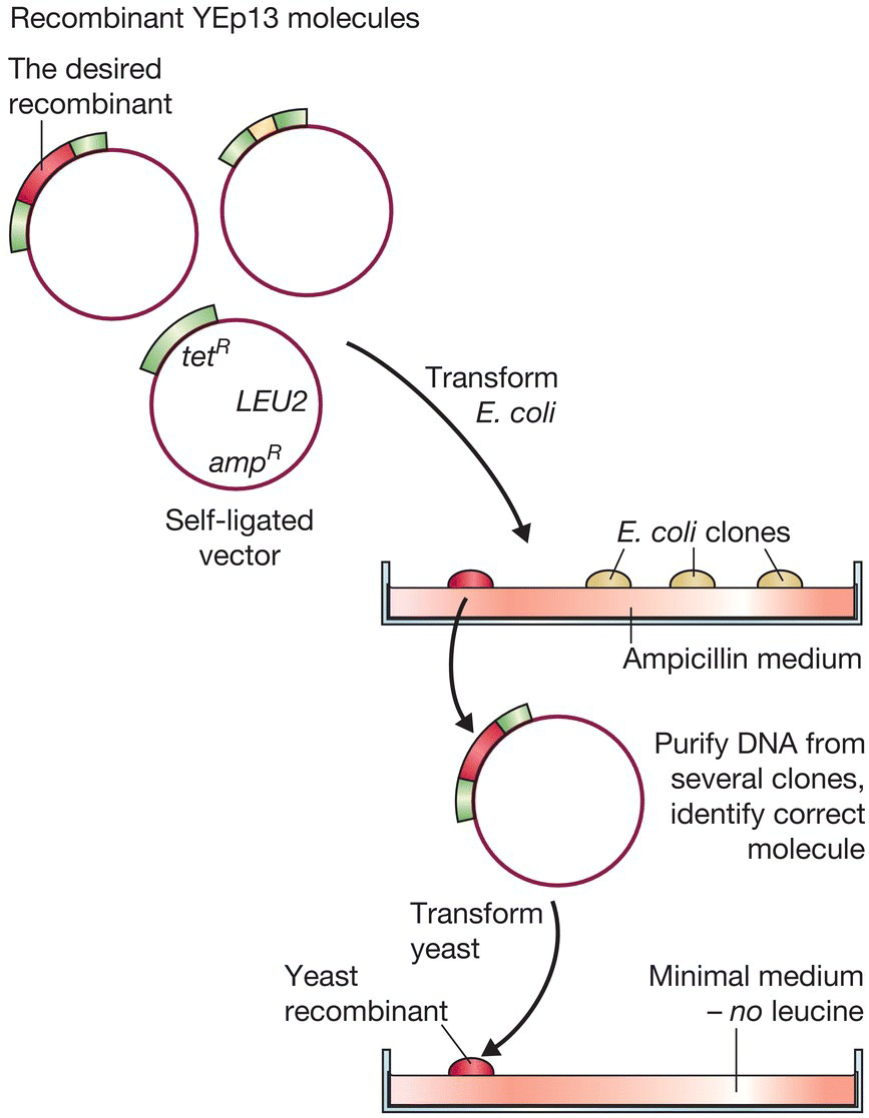
- Yeast episomal plasmids (YEps):
- 为shuttle vector, 能够同时在酵母和大肠杆菌中复制;
- 这一性质使得其能首先通过大肠杆菌进行纯化, 再转入酵母;
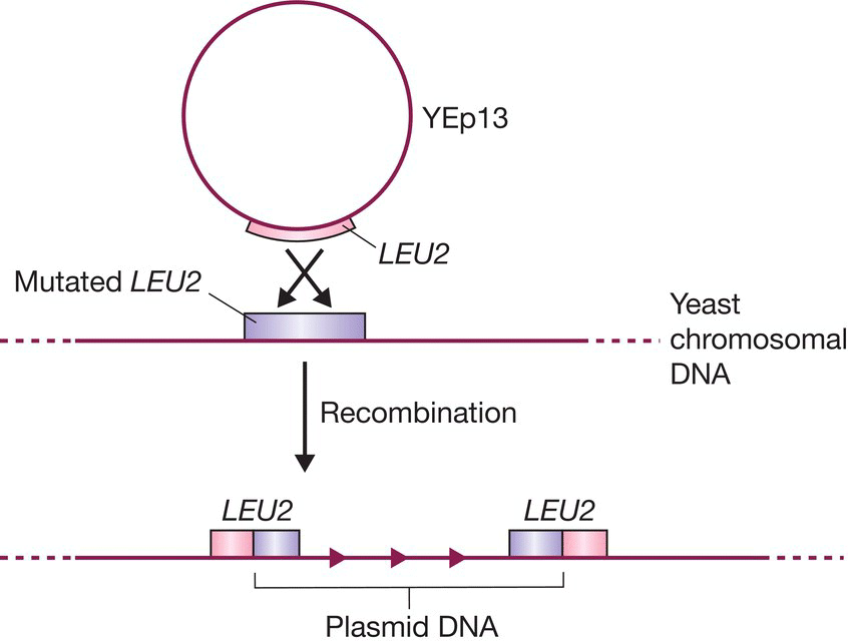
- 载体通过与宿主基因组中同源的基因发生重组从而整合进基因组:
- LEU突变体和酵母LEU基因发生重组.使得质粒进入酵母基因组,类似插入序列,会复制目标片段,形成两个基因,但通常只有一个有效
- 为shuttle vector, 能够同时在酵母和大肠杆菌中复制;
- Yeast integrative plasmids (YIps)
- 跟episome的区别在于没有起始位点,只能通过整合进基因组和宿主一起复制;
- Yeast replicative plasmids (YRps)
- 跟integrative相对, 以质粒形式复制;
- Yeast centromere plasmids (YCps)
- 含有复制区和着丝粒,能够像基因组一样复制,故而被称为mini-chromosome;
- Yeast episomal plasmids (YEps):
- 几种克隆载体比较:
- 转化频率:
- 加入一定量质粒DNA能获得的转化体数(个每微克)
- YEps > YRps,YCps >> YIps
- 拷贝数:
- YEps:20-50
- YRps:5-100
- YIps == YCps == 1
- 重组体稳定性: YIps > YCps > YEps > YRps
- 转化频率:
- 特殊载体:YAC yeast artificial chromosome
- 组成成分:
- centromere: 能够像基因组一样复制
- two telomeres:
- 作用1: 让末端能够正确地被复制;
- 作用2: 避免其被外切酶消化;
- 复制起点;
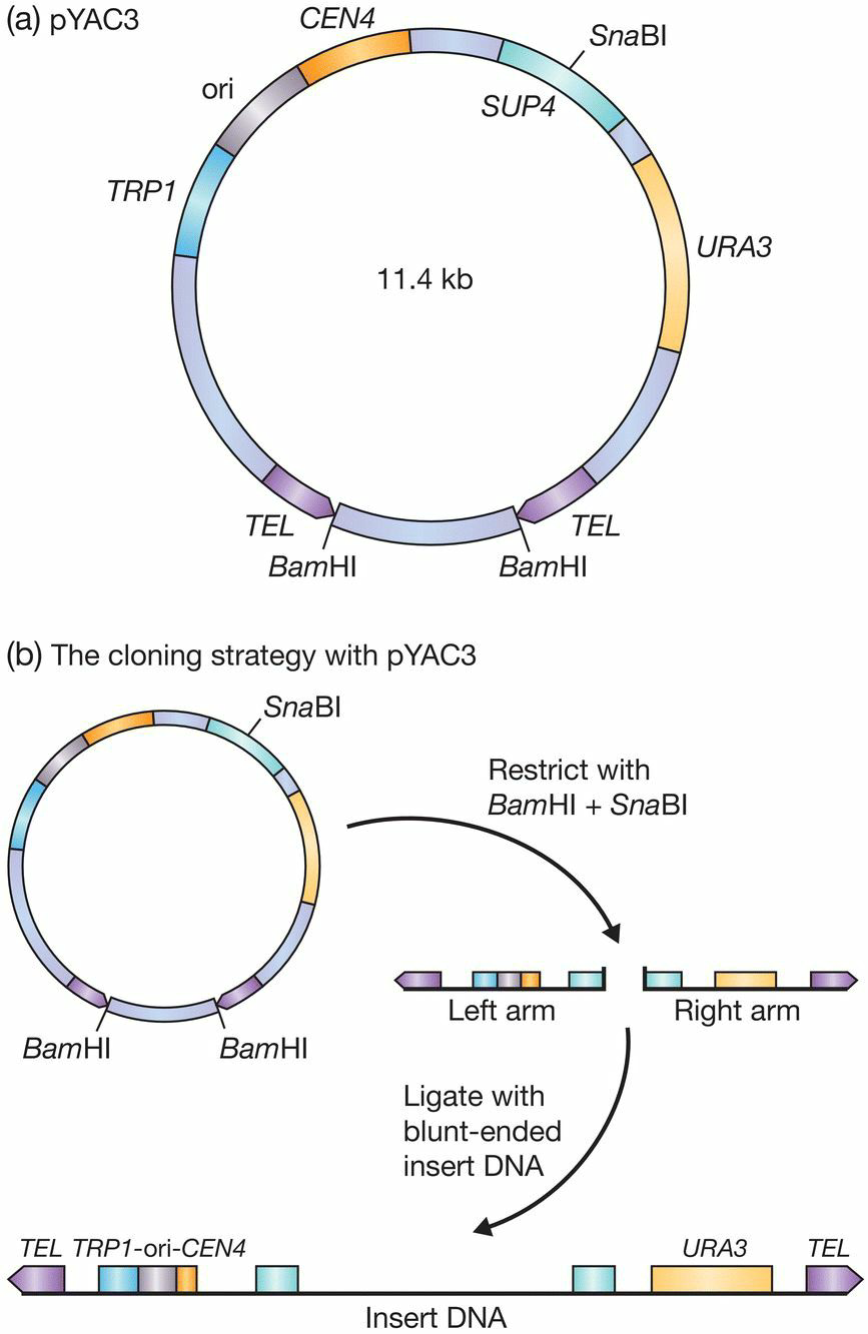
- TEL: act as seeding sequences for telomeres building
- CEN4: DNA from the centromere region of chromosome
- ori: The origins of replication
- SUP4: selectable marker into which new DNA is inserted. Yeast are normally red(accumulation of red pigment), and those transformed with YAC will form colorless colonies.
- URA3 and TRP1: selectable markers.
- Electroporation:
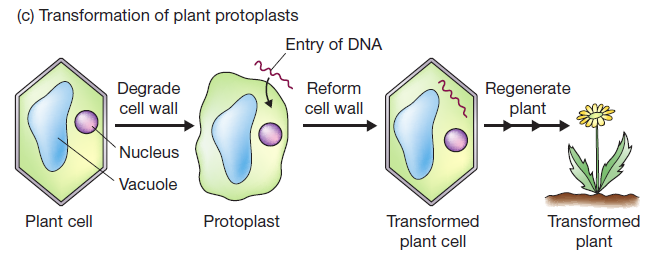
- 电穿孔法:在膜上打出暂时的孔洞从而吸收DNA, 对于植物来说则是要多加两步, 去细胞壁和重新生成细胞壁;
- 组成成分:
- 种类:
- 对于植物:
- Ti(tumor inducing) plasmid:
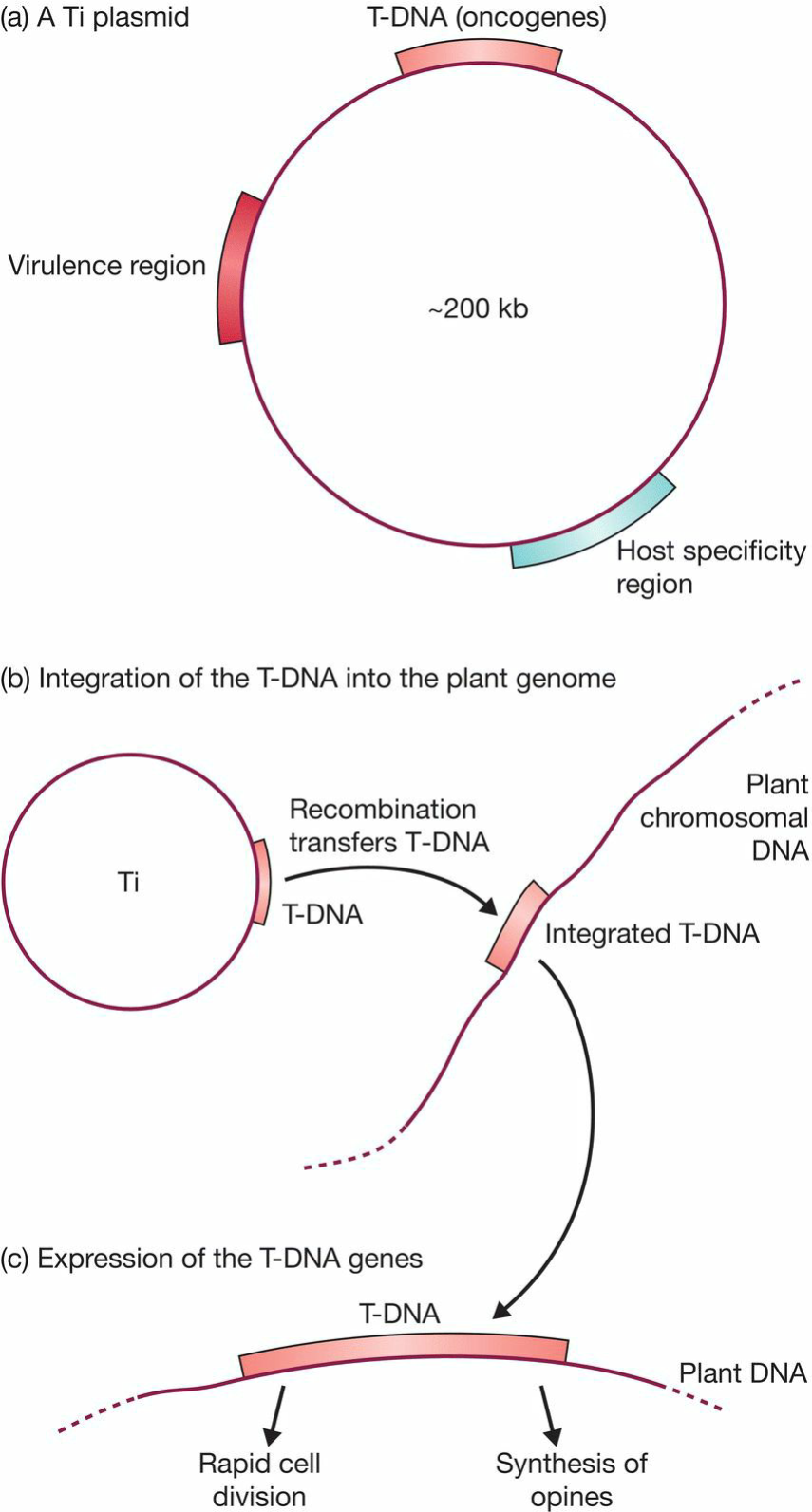
- Ti质粒转染后T-DNA会整合进基因组,从而使细胞表现出成瘤性
- Ti质粒过大, 不利于操作:
- 解决方法1: 双质粒法, 将T-DNA从原来的Ti质粒移出至质粒B,剩下质粒A;
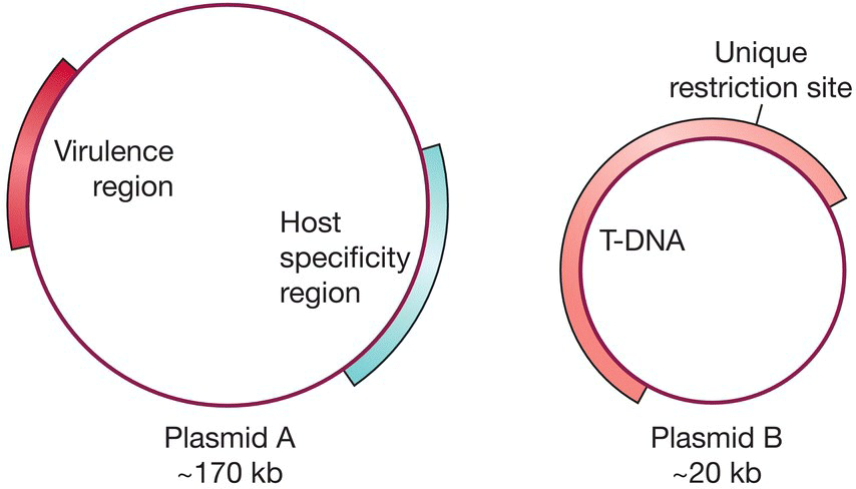
- 质粒A负责表达转移T-DNA的蛋白;
- 质粒B则小到便于我们操作,从而能够添加限制位点;
- 解决方法2:共整合法,Ti质粒加上一个携带有T-DNA同源片段的质粒(含目的基因)
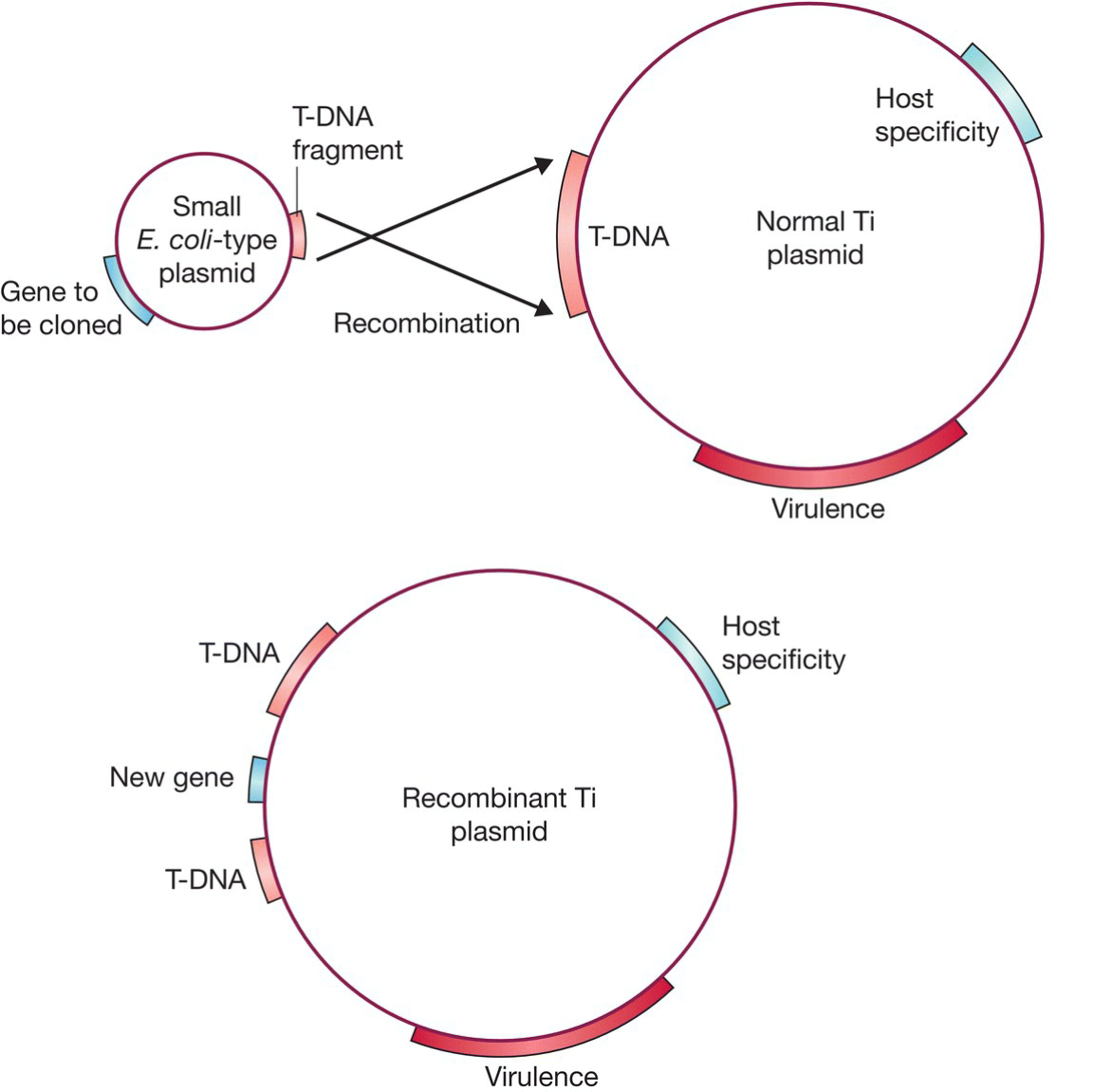
- T-DNA和小质粒发生同源重组,从而将目的基因转移到T-DNA中;
- 解决方法1: 双质粒法, 将T-DNA从原来的Ti质粒移出至质粒B,剩下质粒A;
- T-DNA整合的机理:
- 质粒载体直接转移:
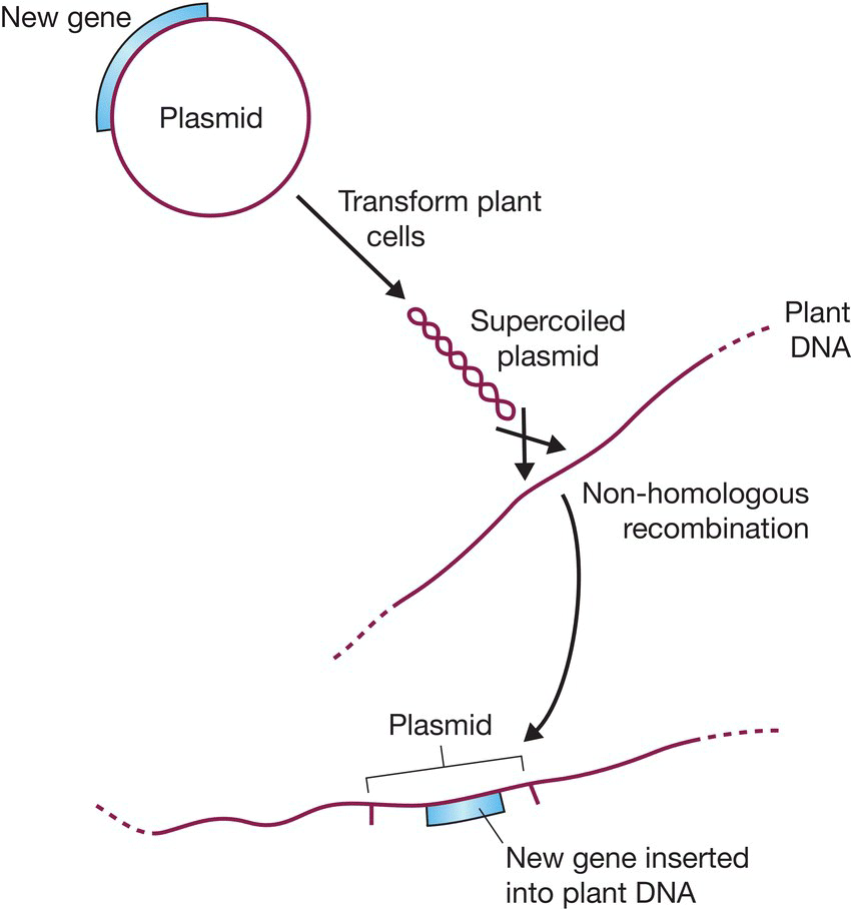
- 超螺旋质粒能够通过同源重组整合进植物基因组;
- 导入细胞的方法: Biolistics,PEG-induced DNA delivery,Electroporation
- 将基因导入叶绿体基因组:
- 通过同源重组导入, 叶绿体数量多,表达量高;
- 植物病毒载体:
- 植物病毒多为RNA,仅有的两种DNA病毒不适合作为克隆载体;
- Ti(tumor inducing) plasmid:
- 动物克隆载体:
- 部分蛋白在细菌或者真菌中无法正常表达;基因疗法,通过将一个基因导入病人细胞;
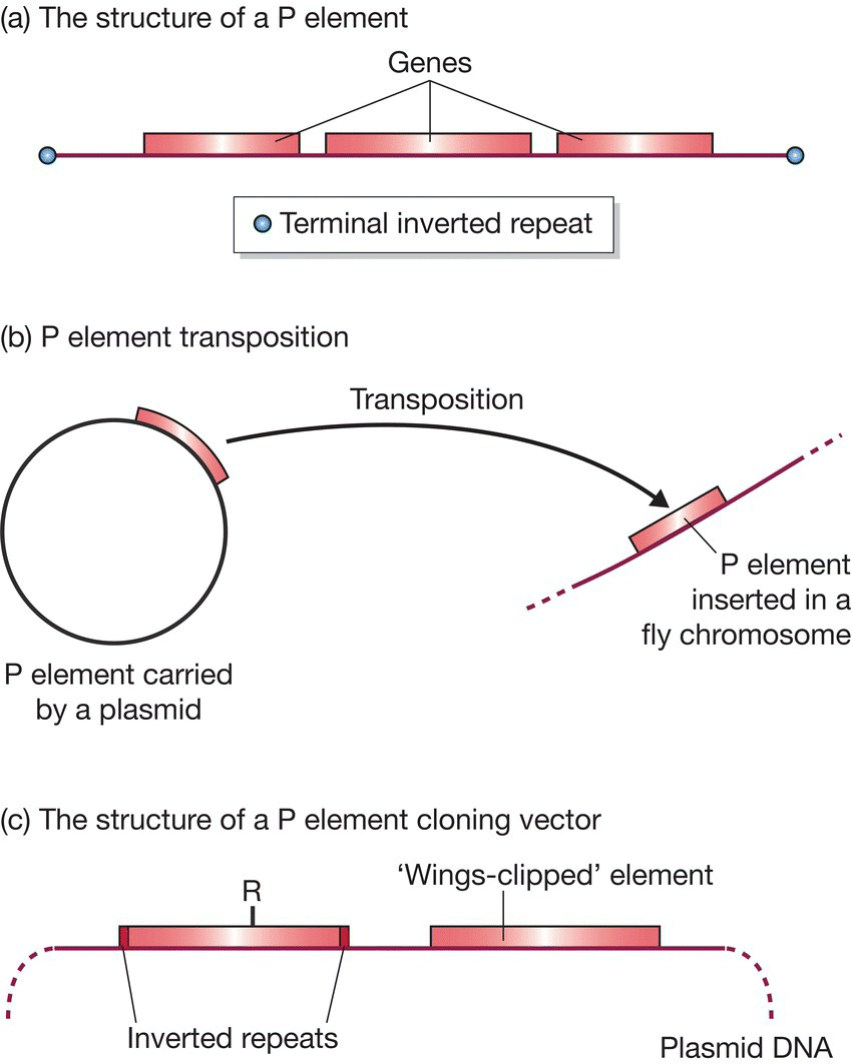
- P elements: